随着各地逐渐入冬成功,身边人打喷嚏、流鼻涕的频率增加了,就好像感冒和流感与冬季存在着某种密不可分的联系一般。细想一下,好像的确在天气寒冷的时间段更容易患上感冒、流感,甚至新冠病毒在冬季也会愈发猖獗,但迄今为止仍然没有发现明确的机制,这是为什么呢?
近日在《过敏与临床免疫学杂志》上刊登的一项研究成果便解答了这一疑惑。研究发现将鼻腔内的温度降低5℃会显著降低鼻内细胞外囊泡的活性。换言之,冷空气的存在损害了发生在鼻子里的免疫反应,使得病毒和细菌有机可乘,人体出现上呼吸道感染概率大幅度增加。此外,在这项研究成果中,研究者提供了第一个生物学机制来解释这一现象的发生。

doi.org/10.1016/j.jaci.2022.09.037
鼻腔是第一道防线
在人鼻黏膜上皮原代细胞(原代HNEpC)中开展体外实验,采用TLR3典型激动剂Poly(I:C)刺激细胞,发现poly(I:C)能够刺激鼻上皮EV分泌,分泌量随着时间延长、剂量增加而增加,且不存在细胞毒性。
确认刺激有效后,随之采用TLR3/dsRNA复合物抑制剂或(和)IRF3激动剂KIN1148验证了这种效应是通过激活TLR3-IRF3信号轴介导的。之后,研究者将TLR3刺激的EV与未刺激的对照EV进行比较,证实二者特征没有显著差异。最后,研究者探讨了TLR3刺激EV在原代HNEpC中的上皮间转运动力学,发现37℃时,细胞摄取迅速,且在60分钟内逐渐扩散到整个细胞质中。然而在氯丙嗪预处理、4℃低温环境下,细胞摄取显著抑制了87.5%,扩散速度显著减慢。表明低温对于细胞摄取EV存在明显抑制作用。

doi.org/10.1016/j.jaci.2022.09.037
TLR3刺激的EV表现出有效的抗呼吸道病毒活性
明确TLR3刺激显着增加鼻上皮EV分泌后,接下来分析这些EV是否具有内在的抗病毒活性。研究者采用冠状病毒CoV_OC43、次要群鼻病毒RV-1B和主要群鼻病毒RV-16分别在原代HNEpC中构建上呼吸道病原体模型,发现原代HNEpC普遍出现细胞质的空泡化、变圆和脱落,并通过病毒dsRNA检测表明已成功诱导细胞病变效应和宿主细胞免疫应答,证实模型成功。
之后评估TLR3刺激的EV介导的体外抗病毒活性,发现TLR3刺激可能会改变EV中的因子物质并赋予EV增强的抗病毒特性。
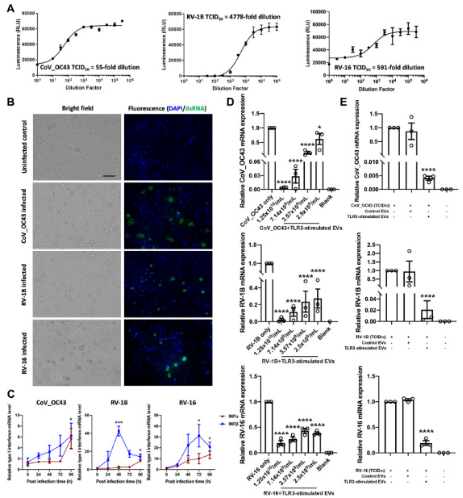
doi.org/10.1016/j.jaci.2022.09.037
TLR3刺激上调EV中的miR-17增强抗病毒活性
明确TLR3刺激的EV有抗病毒活性后,研究者进一步探索了潜在的抗病毒机制,通过层次聚类分析、火山图数据分析,最终发现6个在TLR3刺激后显著上调并与抗病毒作用相关的miRNA,其中将已被报道在上呼吸感染期间抑制病毒复制的miR-17作为待验证的作用机制目标。
采用qPCR证实与未受刺激对照细胞相比,TLR3刺激显着增加了EV中miR-17的表达;在未受刺激对照细胞中,miR-17过表达或沉默发现miR-17抑制了病毒RNA复制,显著降低了宿主细胞中CoV_OC43、RV-1B和RV-16病毒mRNA水平,证实了miR-17对呼吸道病毒的强大抗病毒活性。在TLR3刺激的细胞中,同样进行miR-17过表达或沉默,发现与未受刺激对照细胞相比,TLR3刺激诱导的EV中miR-17抗病毒活性更强,证实TLR3刺激上调EV中的miR-17增强抗病毒活性。
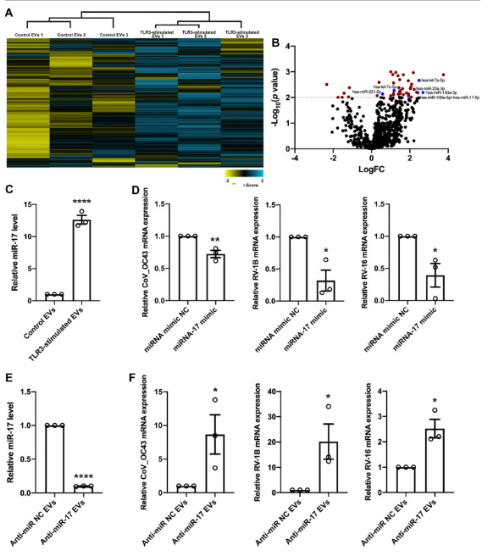
doi.org/10.1016/j.jaci.2022.09.037
TLR3刺激的EV表面受体-病毒结合 有助于抗病毒活性并防止病毒进入宿主细胞
研究者发现TLR3刺激的EV表面受体蛋白质可以与病毒相结合,阻止病毒进入细胞,与细胞受体结合,而未受刺激的对照EV对阻断病毒感染没有显著影响。
研究者分析了TLR3刺激的EV中LDLR,ICAM-1和N-乙酰神经氨酸(NANA)的水平,它们分别参与受体介导的RV-1B,RV-16和CoV_OC43的内吞作用,发现TLR3刺激上调EV中的LDLR和ICAM-1水平,另外因技术限制,NANA无法检测。
为了探索LDLR和ICAM-1在EV中抑制病毒感染的作用,在TLR3刺激的EV中沉默LDLR或ICAM-1 mRNA表达,发现LDLR或ICAM-1沉默回削弱对应的病毒与TLR3刺激的EV之间的相互作用,从而促进病毒进入宿主细胞。

doi.org/10.1016/j.jaci.2022.09.037
冷暴露会损害TLR3依赖性EV分泌和miR-17丰度 从而消除抗病毒活性
研究者分析了降温对TLR3依赖性EV功能的影响。通过人体鼻内温度梯度试验发现当环境温度从23.3℃降低到4.4℃后,前鼻甲和中下鼻甲水平的鼻内温度分别下降了6.4℃和4.7℃。基于上述实验结果,在体外培养实验时采用降低5℃的方法,发现在37℃时,TLR3依赖性EV分泌显着增加,而32℃时,则显著损害了TLR3依赖性EV分泌。
接下来研究冷暴露对TLR3刺激的EV介导的抗病毒活性的影响,发现冷暴露下TLR3依赖性EV抗病毒活性降低,miR-17的丰度降低,表明冷暴露可能通过这种机制来消除抗病毒活性。
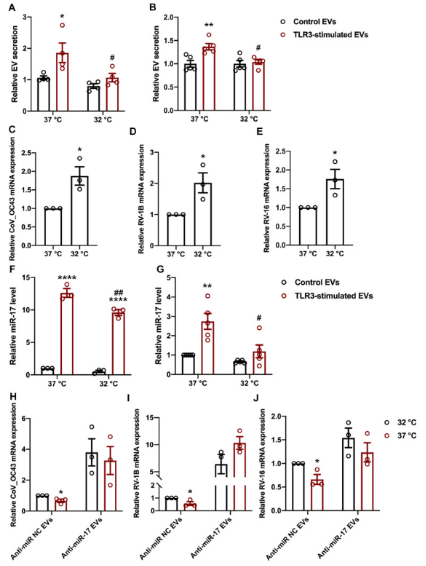
doi.org/10.1016/j.jaci.2022.09.037
冷暴露降低TLR3依赖性EV表面受体蛋白表达,损害由表面受体-病毒相互作用介导的抗病毒活性
在37℃时,与未刺激对照细胞相比,TLR3刺激EV中LDLR、ICAM-1表达显著增加,而当温度降到32℃时,TLR3刺激EV中LDLR、ICAM-1显著受损,表明TLR3刺激EV中表面受体蛋白LDLR和ICAM-1表达增加受环境温度影响。进一步研究发现冷暴露会显著损害由表面受体-病毒相互作用介导的抗病毒活性,但是对于TLR3刺激的EV抗病毒活性没有显著影响。
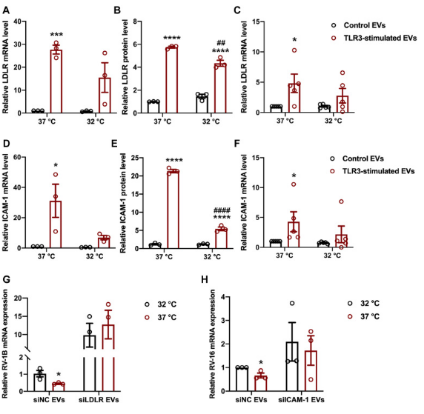
doi.org/10.1016/j.jaci.2022.09.037
小结
上呼吸道感染存在季节性变化,尤其在冬季,感染率增加,这是因为冷暴露会损害由鼻上皮EV介导的抗病毒免疫防御功能,且这可能是通过下调TLR3依赖性EV分泌和miR-17丰度,降低TLR3依赖性EV表面受体蛋白表达等来实现的。
想一想,新冠的到来使得我们离不开口罩,而口罩的存在可以给予鼻腔一定的温暖,间接保护了鼻内免疫防御机制,降低了呼吸道病毒的感染几率,也不失为又一个戴口罩的理由。
参考文献:
[1] Di Huang, Maie S. Taha, Angela L. Nocera, Alan D. Workman, Mansoor M. Amiji, Benjamin S. Bleier,Cold exposure impairs extracellular vesicle swarm–mediated nasal antiviral immunity,
Journal of Allergy and Clinical Immunology,2022. doi.org/10.1016/j.jaci.2022.09.03
来自: 生物谷
更多阅读:

