CardinalHealth发布了“2022年生物仿制药报告”。分析了生物仿制药行业如何推动竞争、降低成本和提高药物可获得性。生物仿制药治疗方案已被证明与原研生物制剂一样安全有效。
生物仿制药通过FDA的简化途径获得批准,其目标是扩大患者获得高质量,低成本的护理。
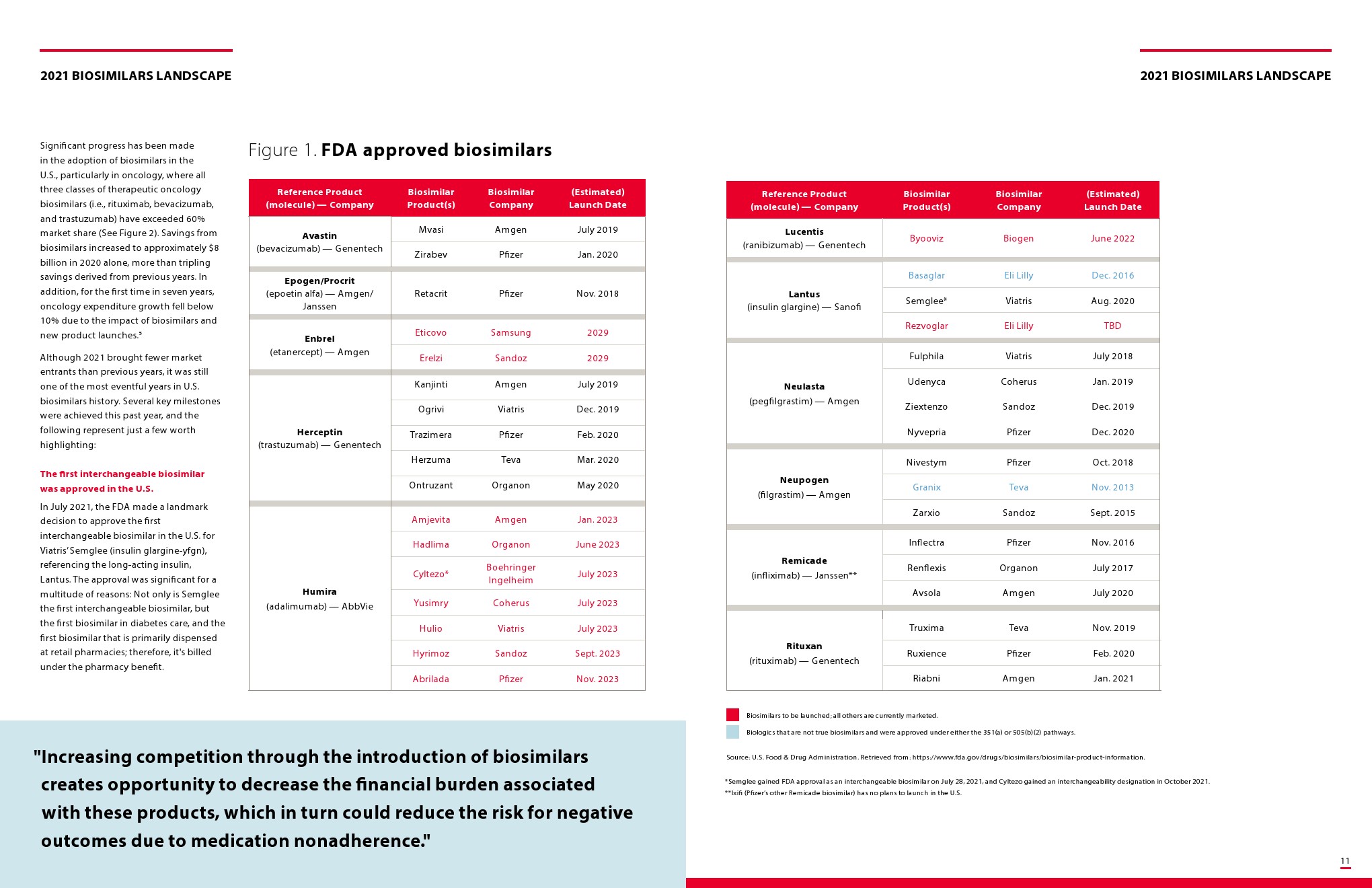
截至2022年1月,美国有33种FDA批准的生物仿制药,其中21种已上市。
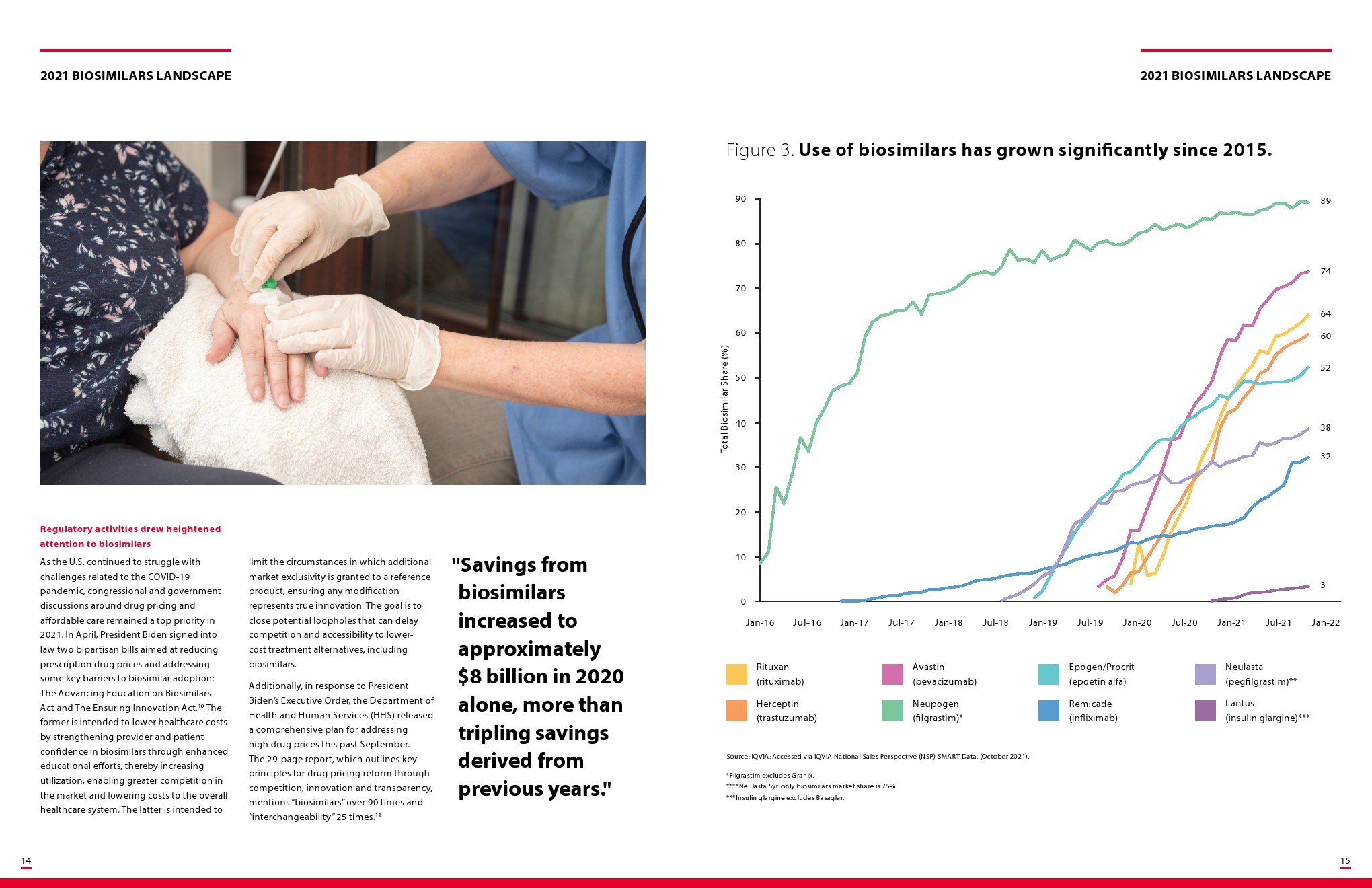
行业分析师表示,到2025年,生物仿制药有望使美国的药品支出减少1330亿美元。
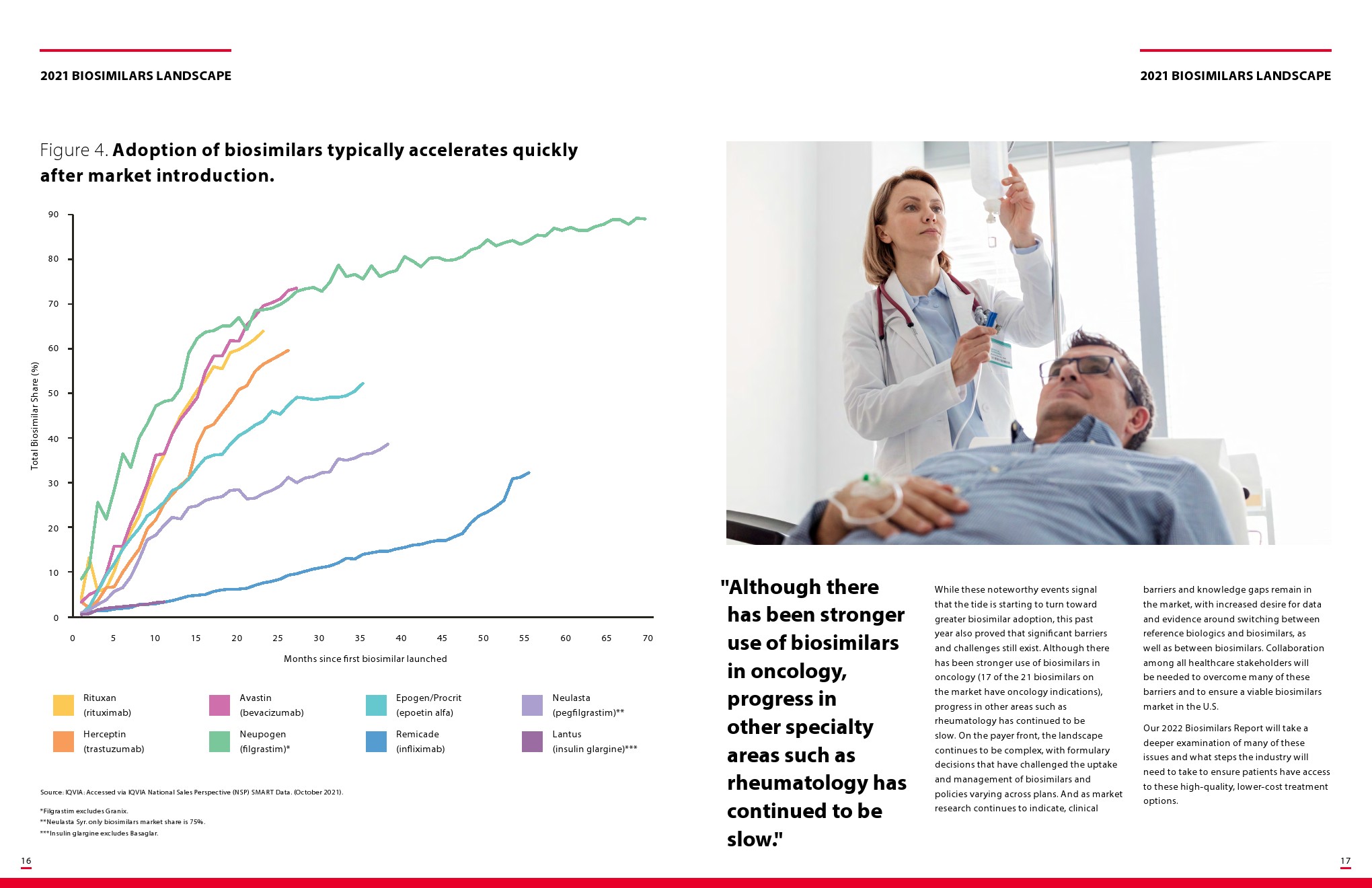
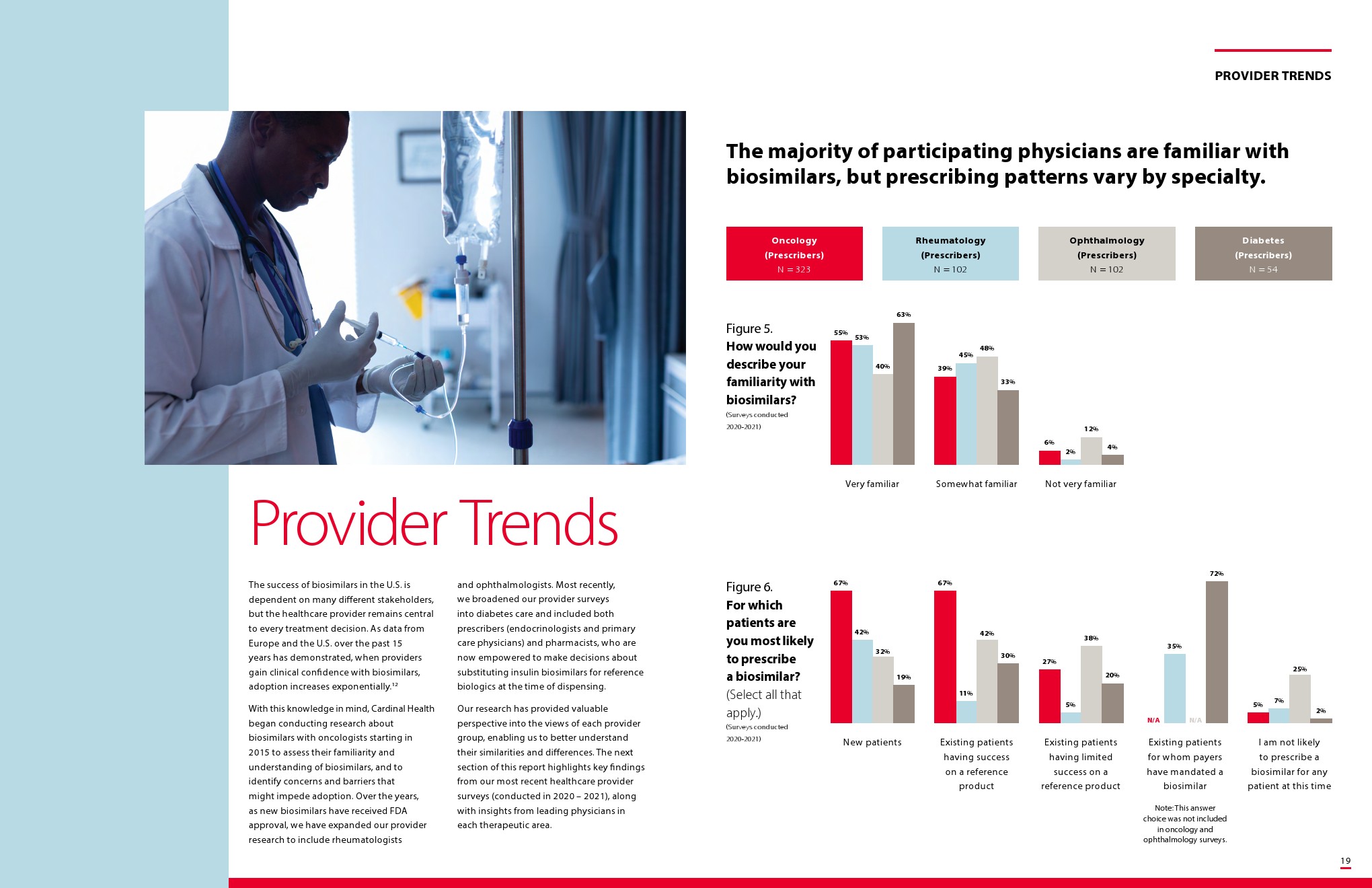
尽管美国食品和药物管理局(FDA)早在7年前就批准了首个生物仿制药,但这类产品对许多从事医疗保健工作的人来说仍然很新鲜,尤其是在糖尿病和眼科等治疗领域最近才开始批准生物仿制药。
什么是生物仿制药?它与仿制药有何区别?
生物仿制药是一种生物制剂(即由活细胞制成),与现有FDA批准的生物制剂一样安全有效。仿制药是由小分子化合物制成的,与品牌药物具有相同的活性成分,生物制剂是由活细胞制成的大而复杂的分子,这导致了与它们相关的固有变异性。因此,当仿制药必须证明与品牌药生物等效性时,生物仿制药必须证明它们与原研药高度相似,因此称为“生物仿制药”。
在美国,生物仿制药目前用于治疗癌症、肾脏疾病、糖尿病和其他自身免疫性疾病,如类风湿关节炎和克罗恩病。
报告还发布了2022年生物仿制药的五个预测:
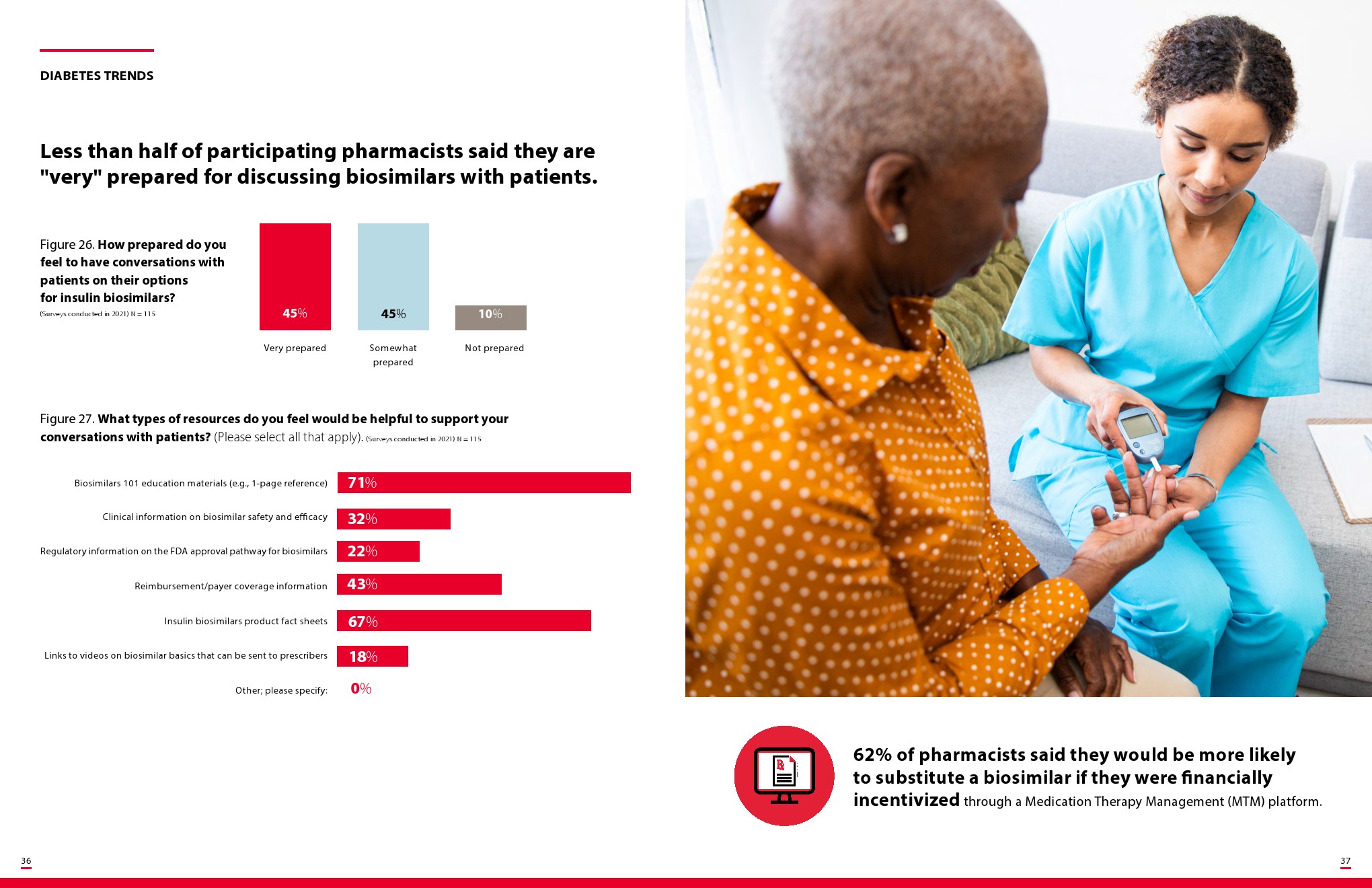
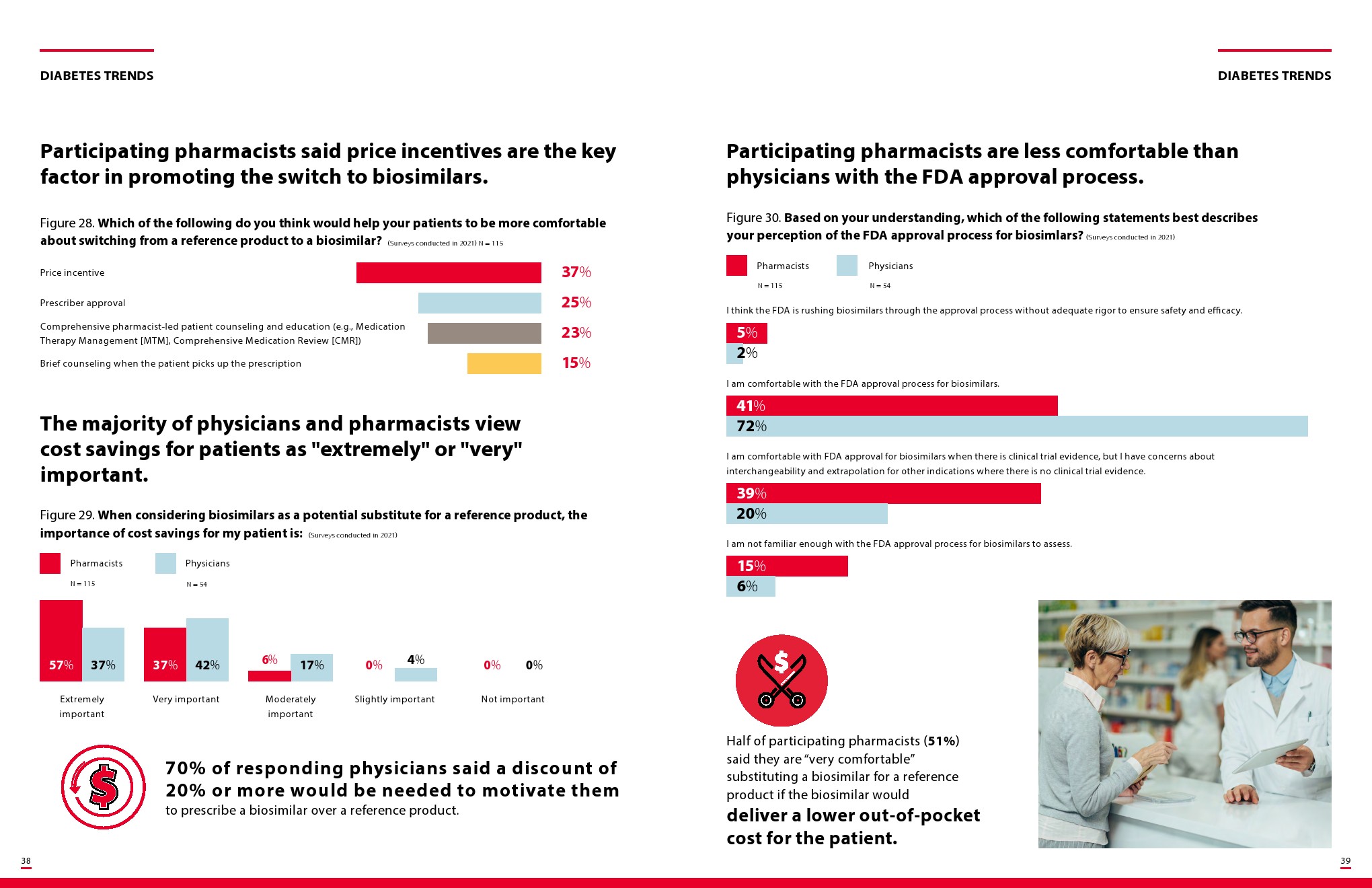
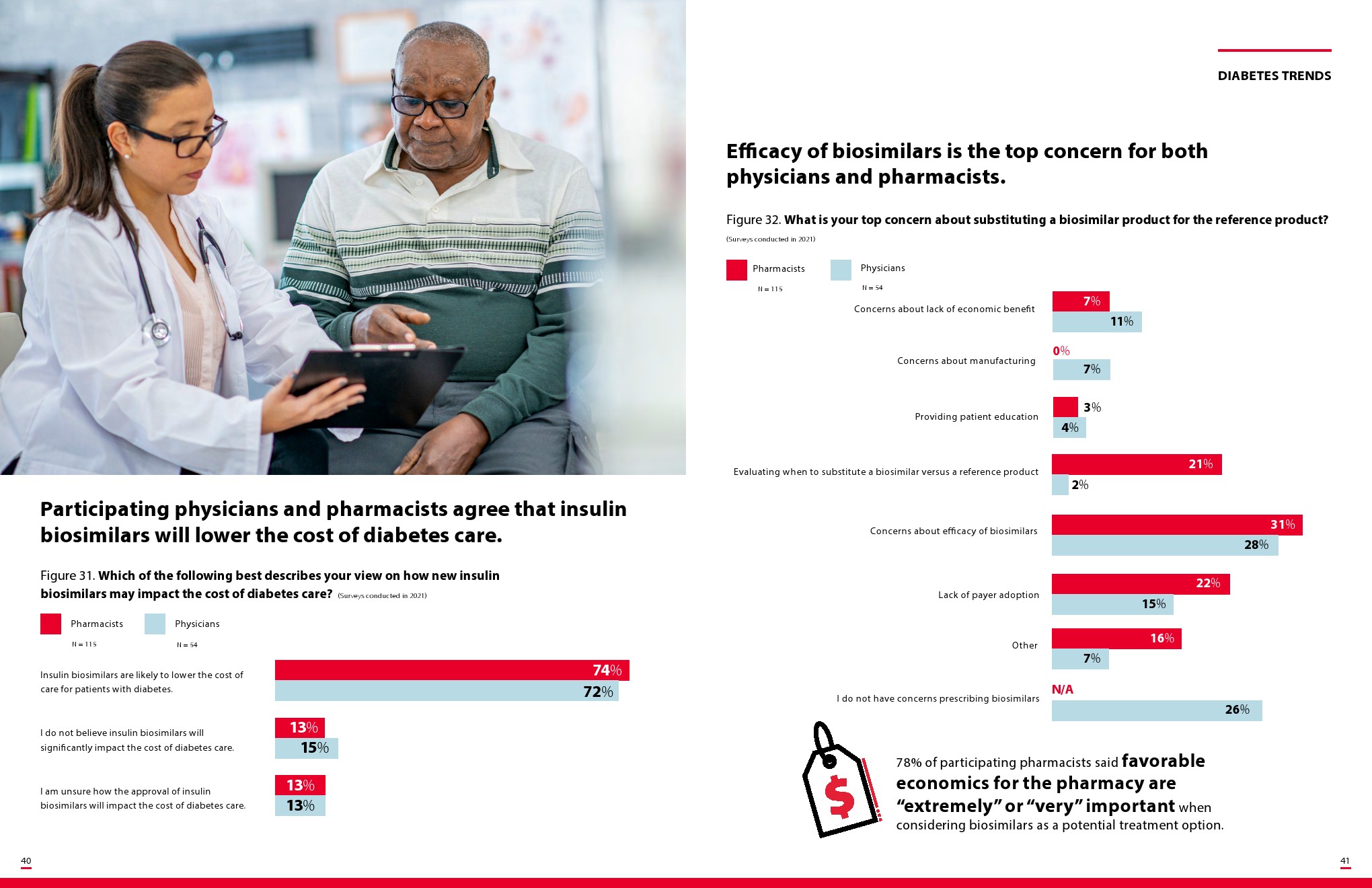
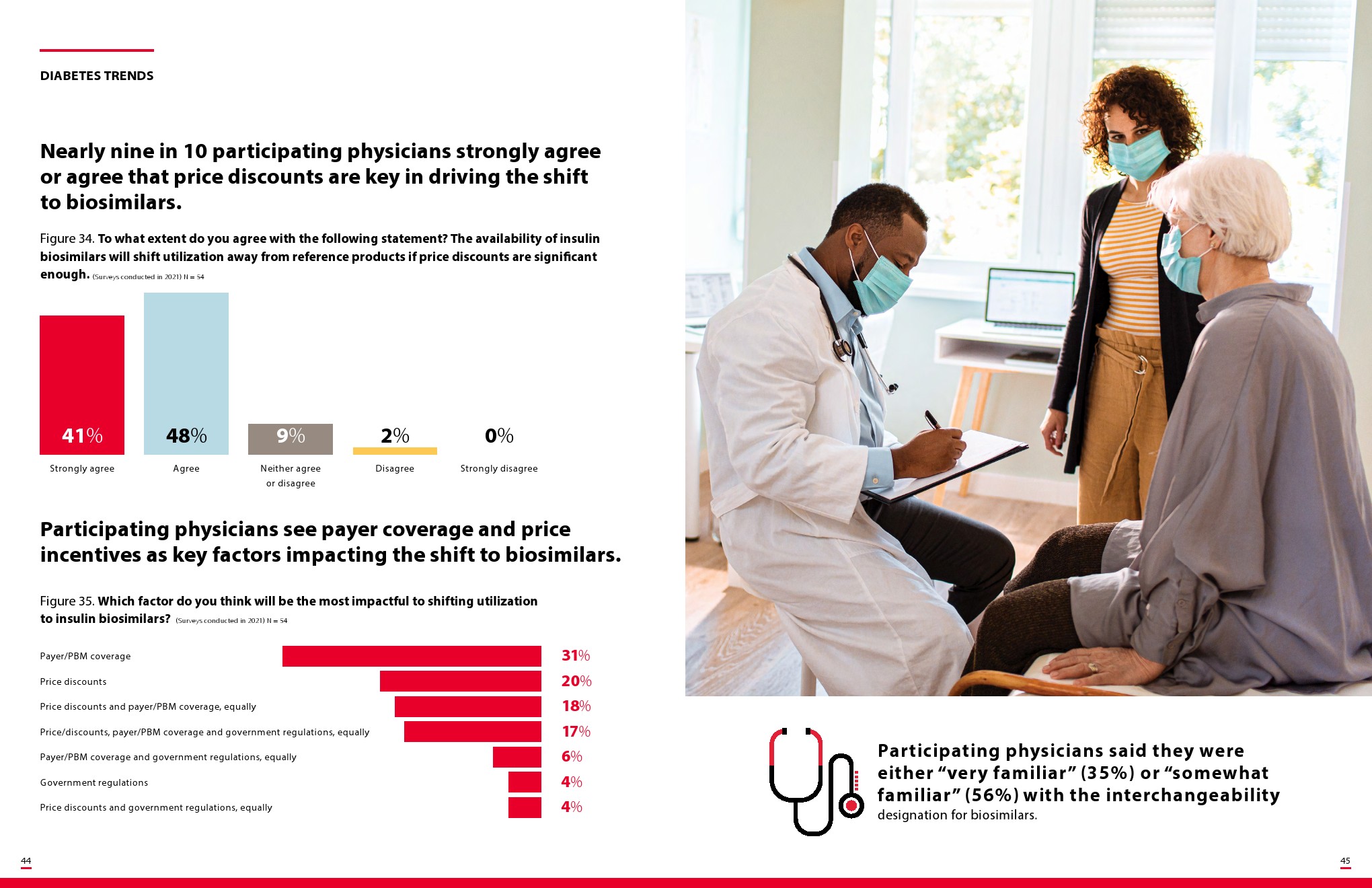
胰岛素生物仿制药将揭示管理医疗利益相关者如何应对可互换的生物仿制药,零售药剂师将被定位为关键的变革推动者
参考生物制剂制造商将采取进一步措施保护市场份额,为2023年推出修美乐生物仿制药做准备
生物仿制药在眼科的应用将是缓慢的,因为对视网膜护理创新的关注仍在继续
美国联邦和各州将出台更多支持生物仿制药的医疗政策
生物仿制药制造商和商业合作伙伴将越来越多地转向现实世界证据(RWE)来证明提供者和支付者的等价性












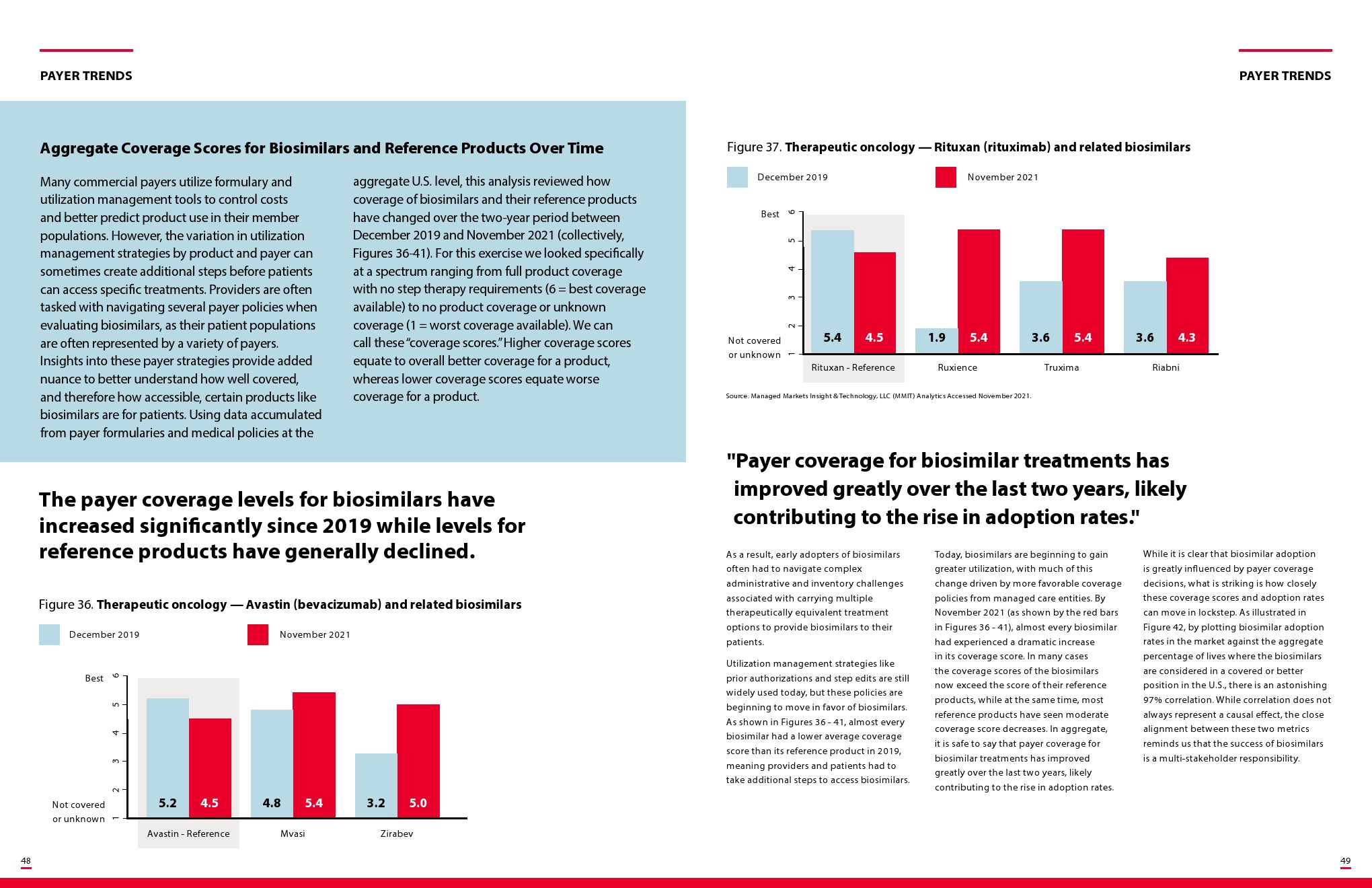
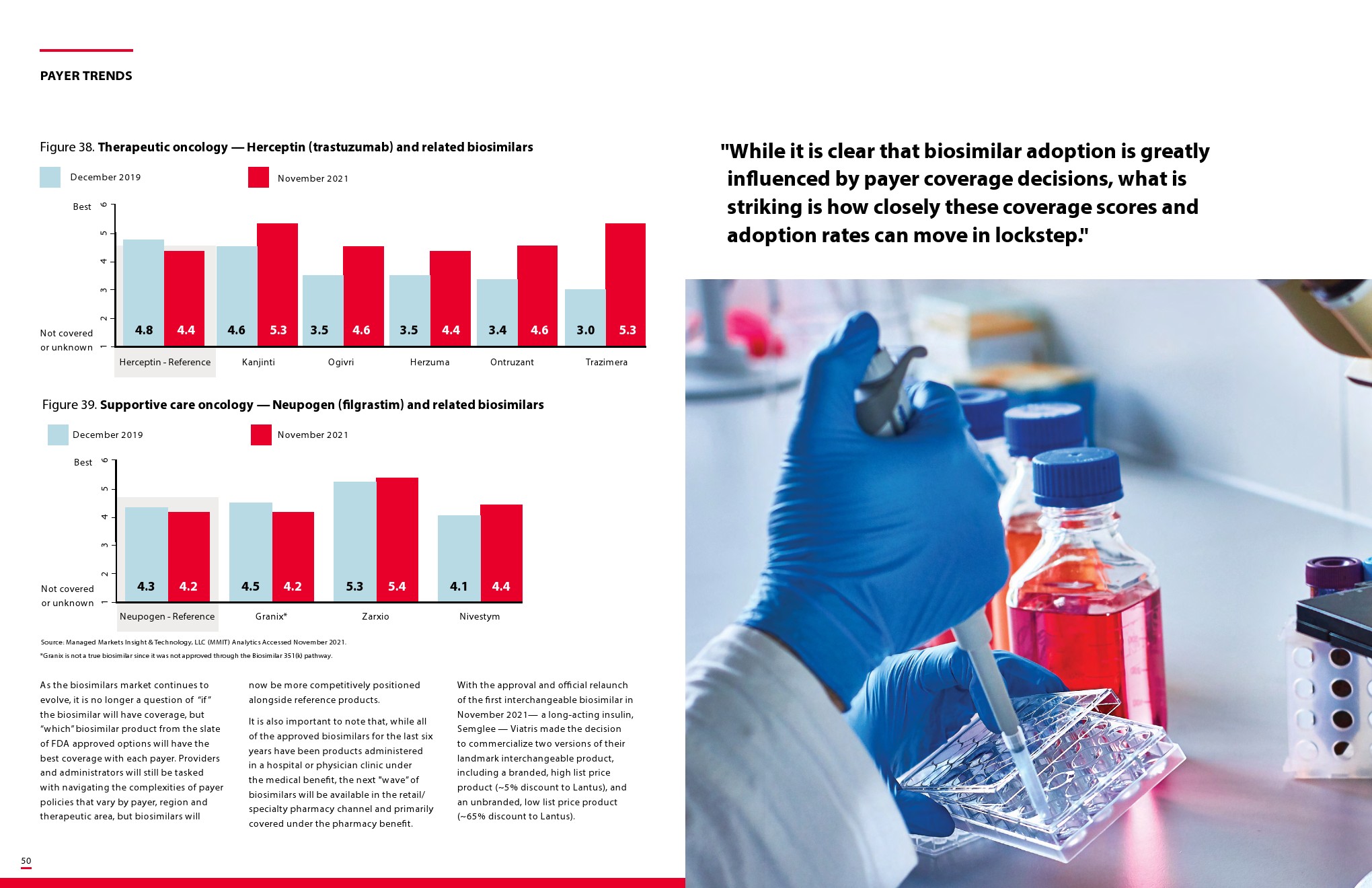
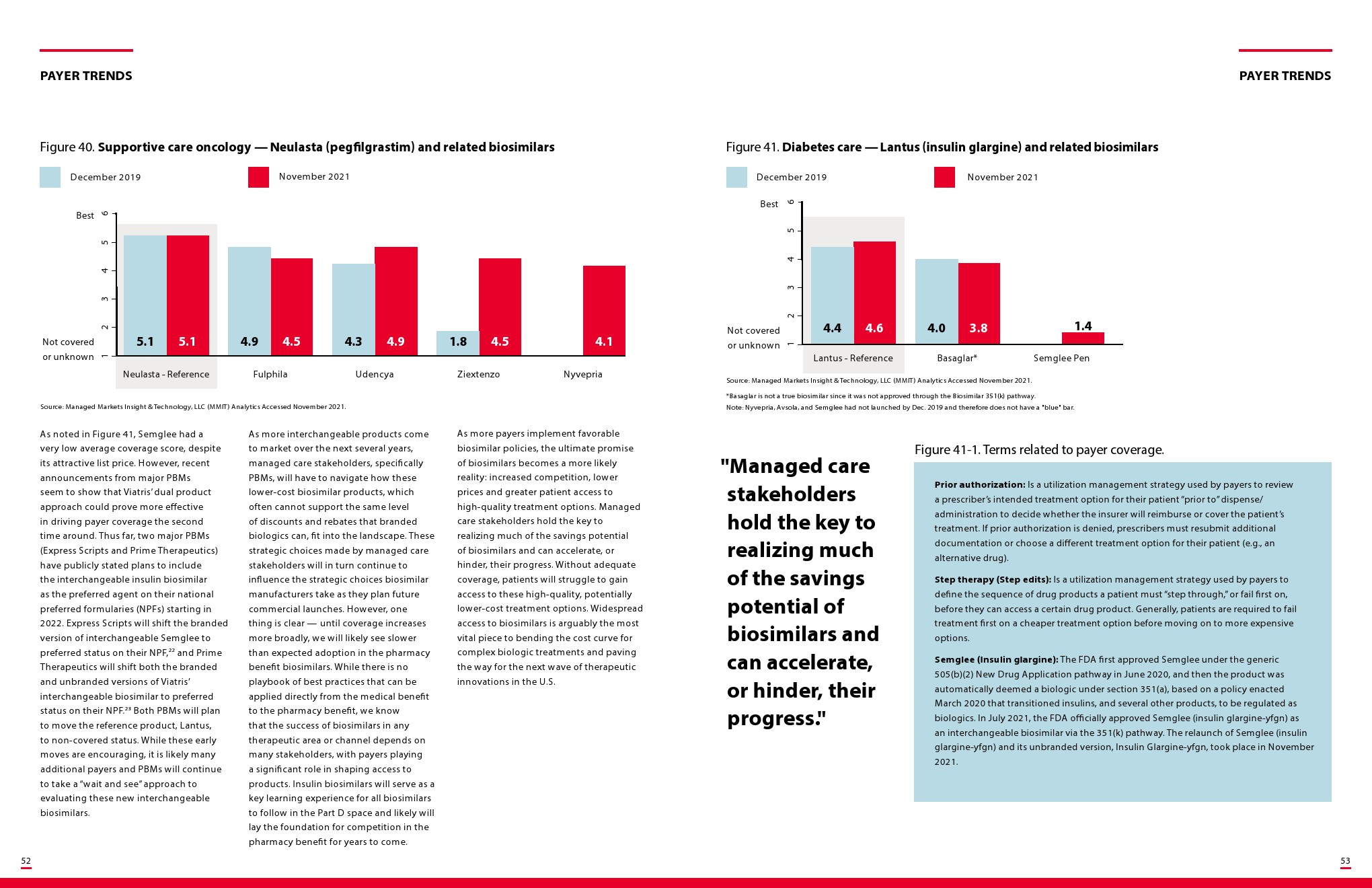
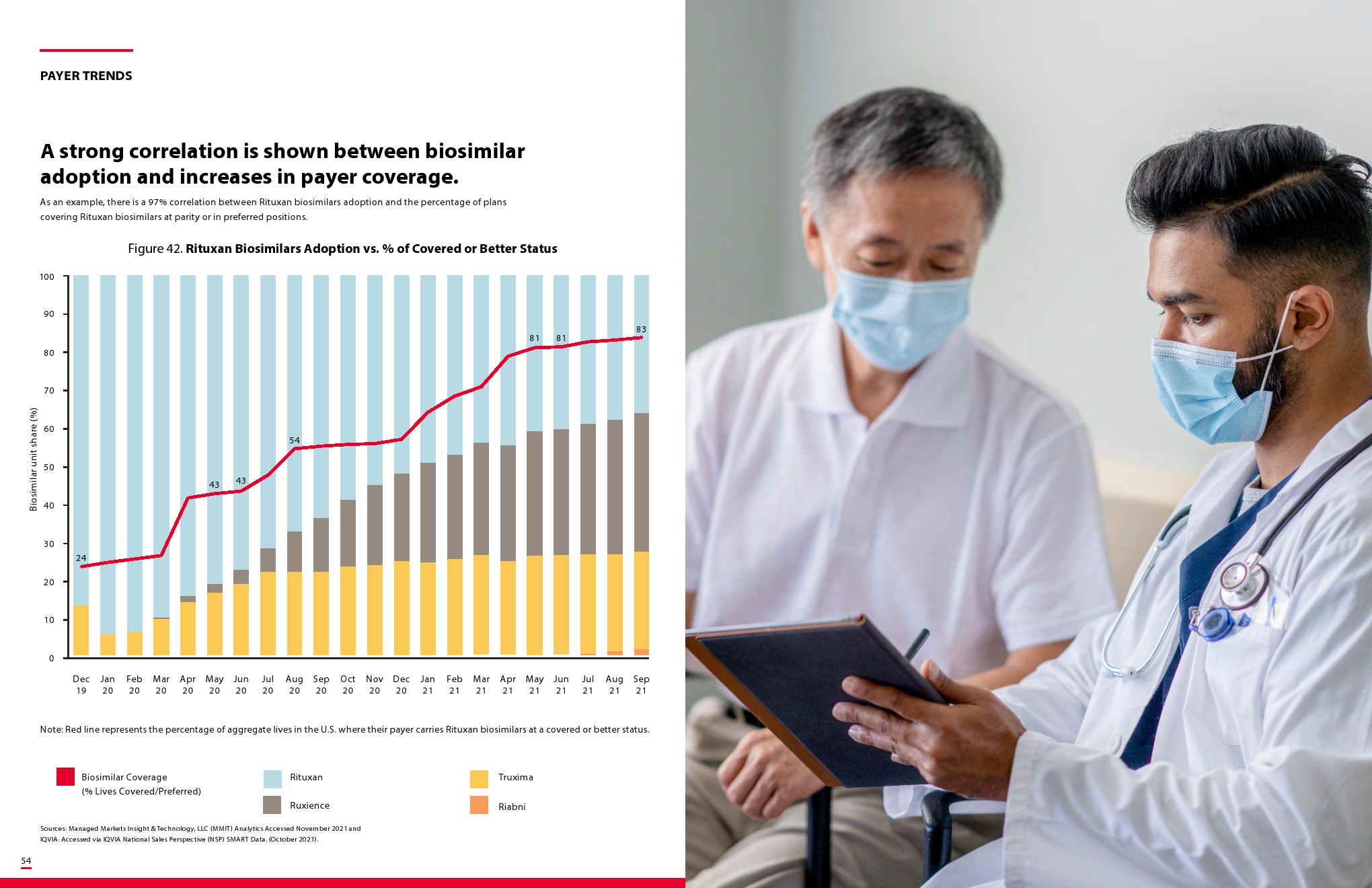


更多阅读:

