神经胶质细胞和神经元细胞是大脑的主要构成细胞,其中神经胶质细胞占据大脑细胞总数的一半以上[1]。
胶质细胞中数量最多,分布最广泛的是星形胶质细胞。尽管科学家对星形胶质细胞的报道最早可以追溯到100多年前,但在很长一段时间内,星形胶质细胞的功能都没有被明确描述。而且神经胶质细胞曾被认为具有很强的同质性,仅仅被认为是填充神经元细胞间隙的间质,是连接神经元的“胶水”[2,3]。
随着多组学技术的进步,大量的研究发现,星形胶质细胞也有一定的异质性:不同时期、不同部位的星形胶质细胞有着不同的细胞形态与功能。近年来,也有研究表明星形胶质细胞在神经环路调控、神经递质循环和神经系统离子稳态调节中扮演了重要角色,在多种神经、精神疾病中,星形胶质细胞也发生了相应的改变[2,4]。
以上这些研究刷新了我们既往对于星形胶质细胞的认识,但对于不同部位星形胶质细胞的异质性目前还还缺乏一个更为系统、全面的研究。
近日,由加利福尼亚大学洛杉矶分校(UCLA)的Baljit S. Khakh领衔的研究团队,在《科学》期刊发表重要研究成果[5]。Khakh教授团队发现,不同脑区的星形胶质细胞因其所处部位的不同,有着特异性的分子特征和功能,而且这些差异基因与星形胶质细胞的形态有一定关联。
值得一提的是,他们还发现,这些差异表达的基因中有些竟然与阿尔茨海默病(AD)相关。他们认为,恢复星形胶质细胞形态,从而改善它们对神经元和组织支持功能,对疾病的治疗或许是有益的。
论文首页截图
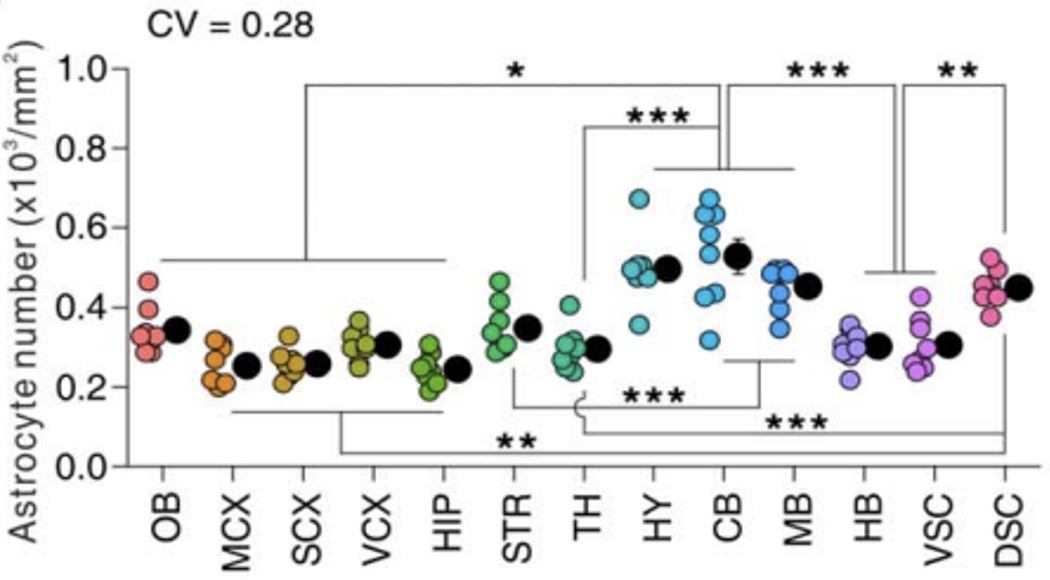
Khakh团队首先利用FAST技术和免疫组化技术,对小鼠脑内星形胶质细胞进行染色标记,发现不同脑区的星形胶质细胞数量有很大差异。
随后,他们检测了中枢神经系统内13个部位的星形胶质细胞基因表达情况,发现不同部位的星形胶质细胞有4000余个共同表达的基因,这些基因主要与离子稳态、神经递质稳态和胆固醇代谢等功能相关,反映了星形胶质细胞的共同作用。
不同部位星形胶质细胞数量差异
而对不同部位星形胶质细胞的差异基因分析及区域富集则发现,位于大脑、小脑、脑干和脊髓的星形胶质细胞有显著的区域性特征。
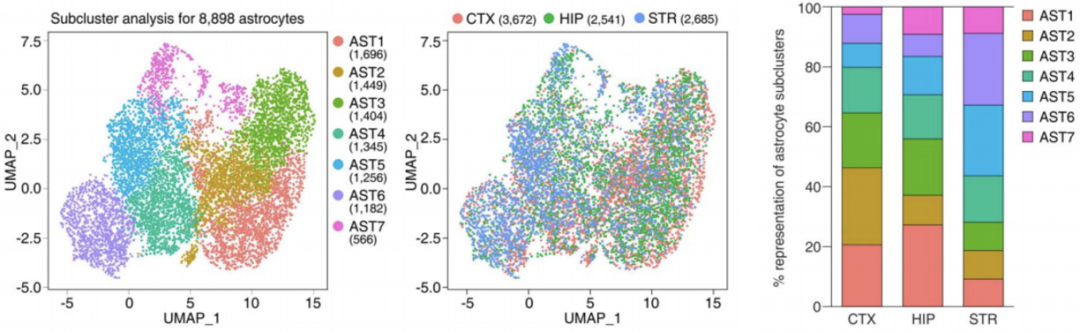
为了进一步探究不同部位星形胶质细胞的差异,Khakh团队对大脑皮质、海马及纹状体的组织取材后进行单细胞转录组分析,发现星形胶质细胞可被分为7个亚群(AST1-7),而且在大脑不同部位,各亚群细胞的比例也有所不同。这些结果表明,星形胶质细胞的区域差异性可能与细胞所处的微环境相关。
单细胞测序后对星形胶质细胞分群及不同部位的分群差异
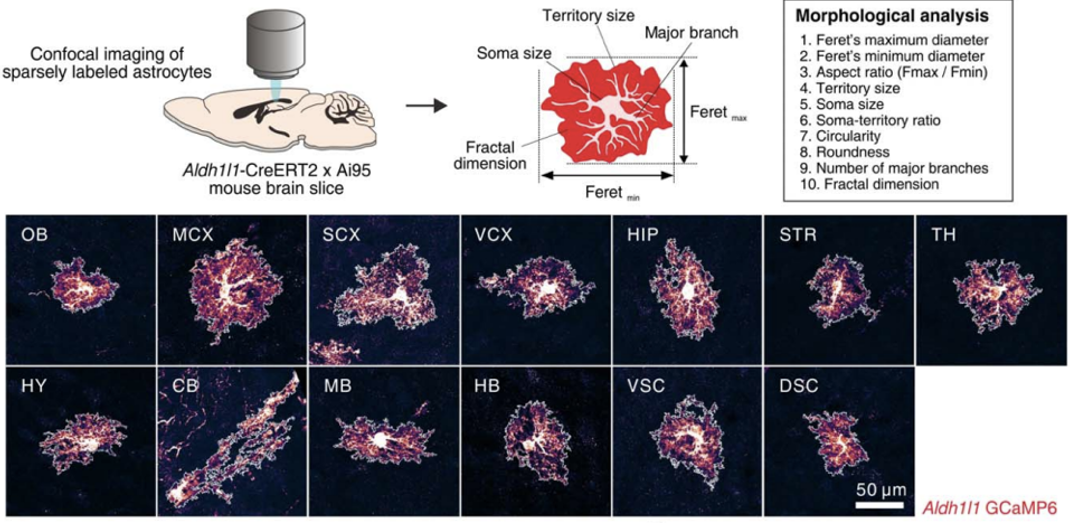
我们都知道,星形胶质细胞的另一大特征是其形态的复杂性,因此Khakh团队利用共聚焦显微镜和免疫组化标记,对13个不同部位的星形胶质细胞进行了形态观察。
通过对比星形胶质细胞胞体大小、分支数量、胞体外基质范围等形态指标,他们发现不同部位的星形胶质细胞的胞体和分支没有很大差异,不过胞体外基质范围则有一定的区域特异性。例如:来自运动皮层(MCX)的细胞更圆,占据的范围也更大,而来自小脑(CB)的细胞则呈现为长条状,占据的范围较小。
不同部位的星形胶质细胞
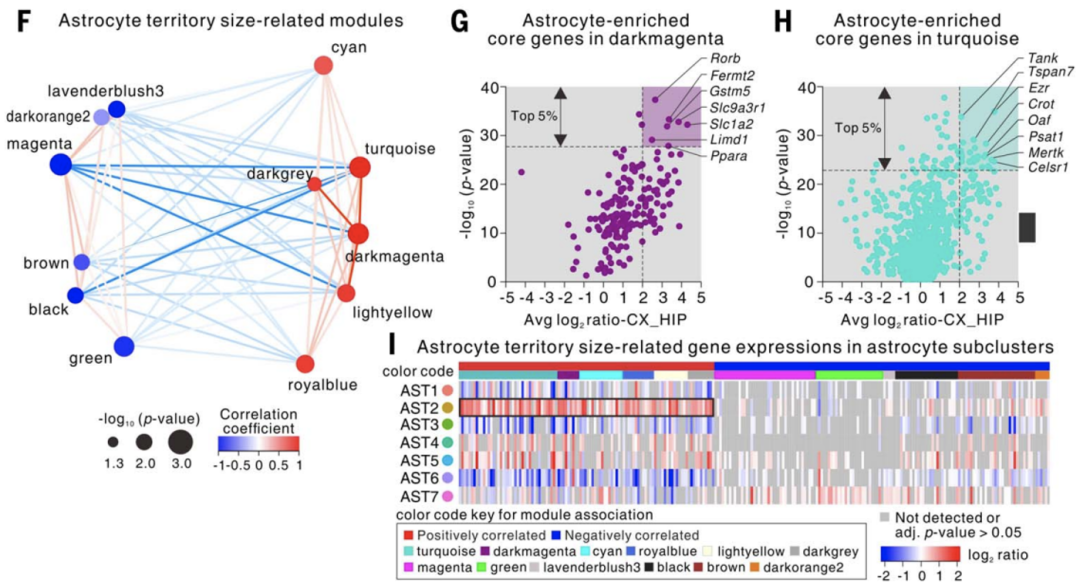
为了进一步探究是什么影响了星形胶质细胞的形态,Khakh团队将这些不同位置的星形胶质细胞形态与此前的基因表达结果相关联,发现与星形细胞的胞体外基质范围相关的基因(Fermt2, Slc9a3r1, Ppara, Ezr, Psat1, Mertk, Celsr1等)。
具体来说,这些基因在AST2亚群(主要集中在皮层,细胞胞体外基质范围较大)中高表达,而在AST6亚群(集中在纹状体,细胞胞体外基质较小)中低表达,与共聚焦观察到的结果一致。
与星形胶质细胞形态相关的差异基因
为了了解形态差异基因是否会影响神经元细胞的功能,Khakh团队敲除了两个与形态相关的基因Fermt2和Ezr,发现星形胶质细胞的形态发生了显著改变:星形细胞胞体外基质范围明显减小,而且小鼠的认知能力也显著下降。
值得注意的是,他们还发现,小鼠海马CA1区细胞cFos基因(与学习、记忆相关[6])表达上调,而且突触前膜和突触后膜有一定程度的分离,表明这些基因不仅影响了星形胶质细胞的形态,还影响了神经细胞、突触的功能。
敲除相关基因后,星形胶质细胞胞体外基质范围减小,小鼠认知与记忆能力下降,海马及突触功能减退
让Khakh团队感到意外的是,他们还在这些与形态相关的基因中发现了与AD相关的基因(如Apoe,Clu,Fermt2)。
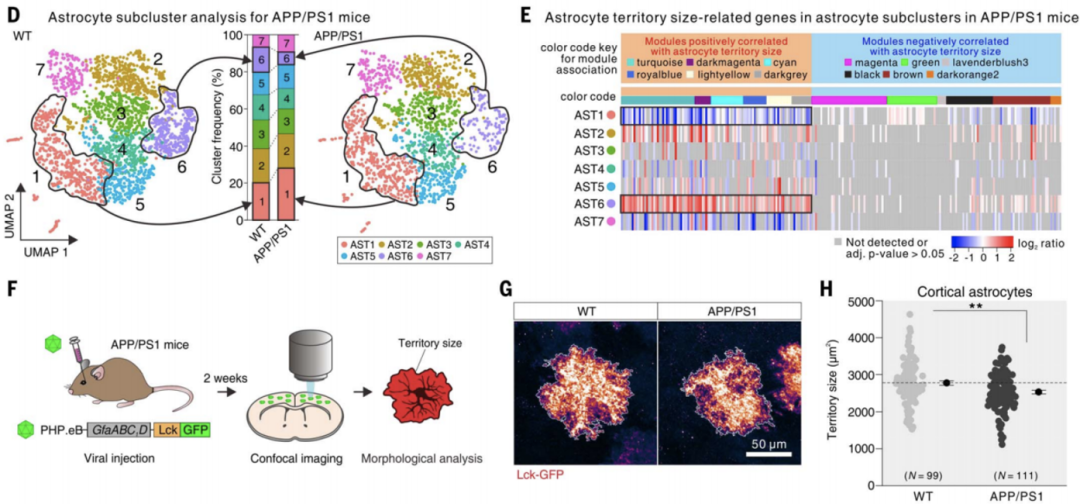
为了了解这些基因与AD的关系,他们对比了AD模型小鼠(APP/PS1)与正常小鼠的星形胶质细胞单细胞测序数据,发现这些基因中与星形胶质细胞胞体外基质范围正相关的基因表达降低,而负相关的基因表达增高,共聚焦显微镜的观察也证实了AD小鼠的星形胶质细胞胞体外基质范围有所减少。
此外,他们还注意到AD模式小鼠中与胆固醇稳态、钾离子稳态、神经递质和突触功能相关的AST6亚群比例降低,而没有上述功能的AST1亚群比例则增高!Khakh团队认为,AST1亚群的细胞的特异性表达基因可能与AD的发病机制相关,为AD带来了新的研究方向和治疗靶点。
AD模型的小鼠的AST6亚群比例降低,AST1亚群比例增高,共聚焦观察其基质范围减小
此外,通过利用公共数据库中的基因表达数据,他们还发现这些调控星形胶质细胞形态的基因,与多发性硬化、强迫症、肌萎缩侧索硬化等多种疾病相关,可见星形胶质细胞的形态改变可能与多种神经精神疾病相关,至于这些改变对疾病的具体影响机制,还有待进一步探索。
总的来说,Khakh团队的这项工作证实了近些年对于星形胶质细胞的猜想,在发现星形胶质细胞异质性的同时,也发现了很多我们此前没有注意到基因表达和信号通路差异,为星形胶质细胞研究领域开拓了一片新的沃土。
这个研究也让我们对星形胶质细胞和与之相关的疾病有了新的理解和思考,期待未来针对星形胶质细胞更多的疾病机制和治疗研究。
参考文献:
1 Barres BA. The mystery and magic of glia: a perspective on their roles in health and disease. Neuron. 2008;60(3):430-440. doi:10.1016/j.neuron.2008.10.013
2 Lee HG, Wheeler MA, Quintana FJ. Function and therapeutic value of astrocytes in neurological diseases. Nat Rev Drug Discov. 2022;21(5):339-358. doi:10.1038/s41573-022-00390-x
3 Chai H, Diaz-Castro B, Shigetomi E, et al. Neural Circuit-Specialized Astrocytes: Transcriptomic, Proteomic, Morphological, and Functional Evidence. Neuron. 2017;95(3):531-549.e9. doi:10.1016/j.neuron.2017.06.029
4 Khakh BS, Deneen B. The Emerging Nature of Astrocyte Diversity. Annu Rev Neurosci. 2019;42:187-207. doi:10.1146/annurev-neuro-070918-050443
5 Endo, F., et al. Molecular basis of astrocyte diversity and morphology across the CNS in health and disease. Science.2022;378, eadc9020.
6 Herrera DG, Robertson HA. Activation of c-fos in the brain. Prog Neurobiol. 1996;50(2-3):83-107. doi:10.1016/s0301-0082(96)00021-4
来自: 奇点神思
更多阅读: