美国食品药品监督管理局(FDA)批准使用Quidel Corp.的抗原检测,这是此类新冠病毒检测方法首次在美国得到批准。
Sofia®2 SARS 快速抗原诊断试剂已获得美国食品和药物管理局(FDA)的紧急使用授权(EUA),适用于 Sofia 2 平台,使用符合 CDC COVID-19 感染标准的疑似患者的鼻或鼻咽拭子标本进行快速检测。
根据周六一封电邮声明,FDA授予Quidel的Sofia 2 SARS Antigen FIA紧急使用授权。该机构称,这是“旨在快速检测导致Covid-19的病毒的新型诊断检测方法”,可在几分钟内得出结果。
FDA警告称,抗原检测对病毒具有很高的针对性,但敏感性较低,意味着得出的阳性结果准确性高,但得出假阴性结果的可能性也会更高。如果被测者结果呈阴性,为慎重起见预计还需进行病毒感染检测。“这只是第一个获得授权的抗原检测,我们预计还会有更多。”
Quidel的首席执行官表示该公司正在加紧生产相关试剂,正式商品名称为Sofia 2 SARS Antigen FIA,目标是每周生产100万份。
Quidel公司成立于1979年,由DavidH.Katz博士在圣地亚哥创立。1968年,Katz在杜克大学获得医学博士学位。在博士期间在Scripps研究所跟随Frank J. Dixon博士从事免疫学研究。随后又在国家卫生研究员继续做了4年免疫学相关研究。此后,Katz在哈佛大学病理科任职,并在哈佛大学期间,发明了一种生物技术,他称之为过敏抑制因子,并且申请了专利。
1979年,Katz博士从研究所离职,创立了一家生物技术公司,专门从事过敏抑制因子研究,他坚信这种生物技术能够开发出一种消除所有过敏的药物。因此,从风险投资人处获得了150万美元风险投资之后,Katz博士正式成立了Quidel公司。
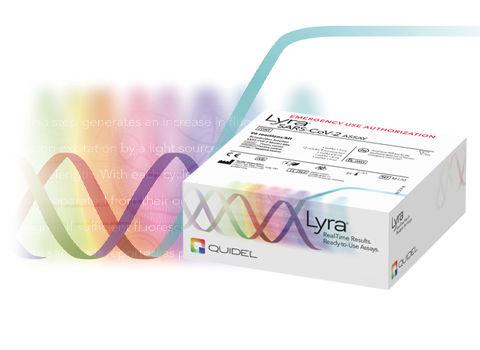
2011年,Quidel公司推出免疫荧光检测平台Sofia。2012年,Quidel公司推出两个第一代分子诊断系统——AmpliVue,Lyra,开始布局POCT分子诊断领域。
2017年10月,在雅培收购POCT诊断巨头Alere时,由于反垄断要求,Quidel公司趁机将Triage快速诊断业务,以及贝克曼的BNP业务收入囊中。Triage是国际领先的快速诊断平台,拥有完整的心肌检测套餐。
据Quidel官方微信公众号显示,其中文名为快臻。产品线主要分为以下几类:(1)侧流技术,在感染疾病和生殖健康领域的市场领导者(2)直接荧光抗体,以专业享誉感染疾病和病毒学领域(3)微量滴度产品,主要针对骨骼和补体通路市场(4)免疫荧光产品(Sofia)和(5)分子诊断产品,包括第一个 FDA 批准上市的手持式分子检测仪-AmpliVue。此外,更多的分子检测和 Sofia 检测项目正在研发或临床试验阶段。
如需乐普检测试剂盒,谊安呼吸机 请联系:微信7281670
更多阅读:

