众所周知,幽门螺杆菌与胃癌密切相关。
有研究认为,90%左右的胃癌可归因于幽门螺杆菌的感染[1]。
然而,奇怪的是,全球约50%的人感染了幽门螺杆菌,但是感染者终身罹患胃癌的风险为1-5%[2]。
看完上面那组数据,我相信你肯定和我一样,在心里有个大大的疑问:到底是什么决定了哪些感染者患胃癌,哪些感染者不患胃癌啊?!
目前已有的研究认为,主要影响因素是遗传背景、居住环境、饮食习惯和生活方式等[2]。不过,这些因素显然不能很好地解释这一现象。近几年来,有科学家开始从幽门螺杆菌入手,发现幽门螺杆菌的一些遗传变异显著增加了它与胃癌之间的关系[3,4]。
这些发现意味着,有些基因型的幽门螺杆菌更毒一些,导致它们促进胃癌发生的能力更强一些。遗憾的是,之前的两个研究虽然发现了潜在的变异位点,但都没有系统的阐释这些变异是如何让幽门螺杆菌更毒的。
近日,由德国埃尔朗根-纽伦堡大学Steffen Backert领衔的研究团队,在著名期刊《细胞·宿主和微生物》上发表一项重磅研究成果[5]。
他们在分析了1043个幽门螺杆菌的基因组数据之后,发现幽门螺杆菌丝氨酸蛋白酶HtrA中一个碱基的替换,会导致第171位氨基酸从丝氨酸变成亮氨酸(171S→L),与胃癌的发生显著相关。
从机制上讲,幽门螺杆菌的171L变异会导致更严重的胃上皮损伤,让幽门螺杆菌更容易钻进胃上皮的深部,注入毒素和促炎的能力更强,还会促进宿主胃上皮细胞的DNA双链断裂。
据了解,这是科学家首次发现与胃癌相关并开展功能验证的细菌变异。毫无疑问,这一发现对于胃癌的防治有重要意义,171L型幽门螺杆菌感染者需要尽快开展根治性治疗。
论文首页截图
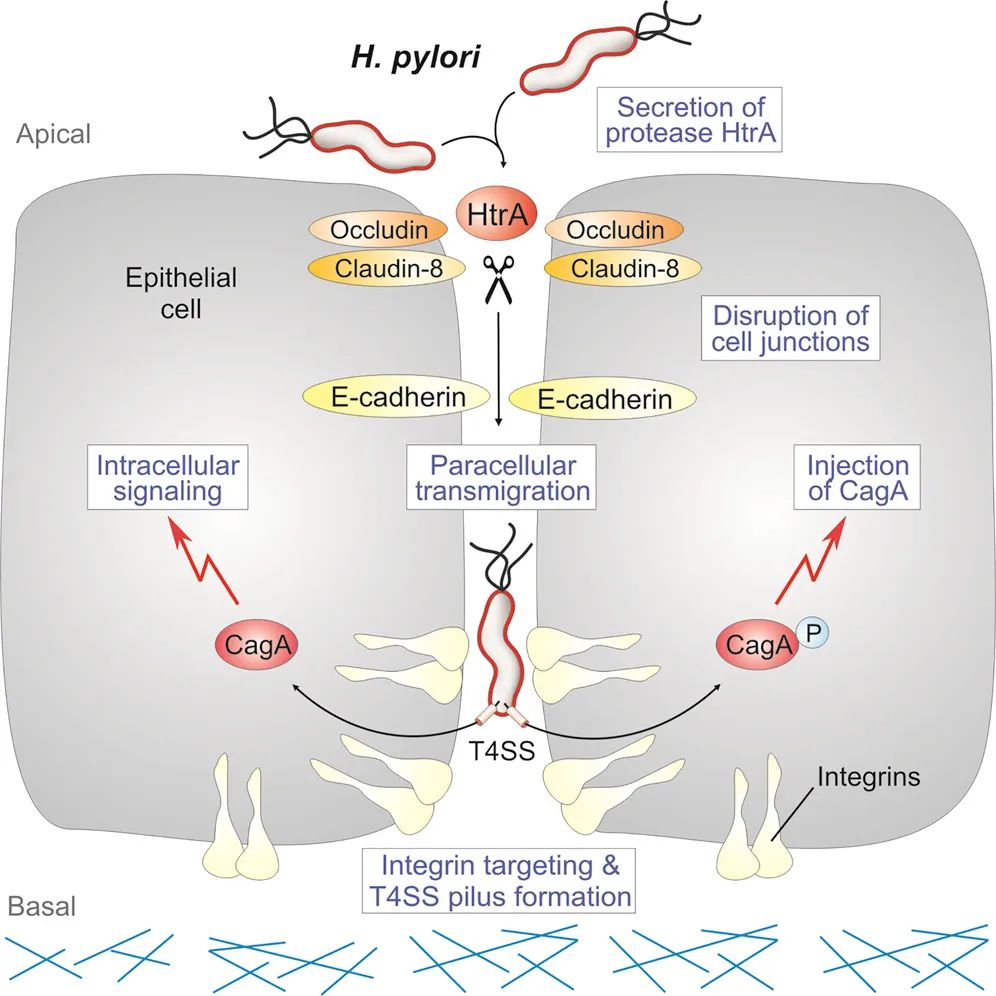
从幽门螺杆菌的致病机制上来看,它们有个IV型分泌系统(T4SS),通过这个“注射器”,它们能将癌蛋白毒性相关基因A(CagA)抗原注射到胃上皮细胞,引发一系列的胃部病变。
早在2017年,Backert团队就发现,幽门螺杆菌不能从胃上皮细胞的顶端注射CagA,而需要穿过上皮细胞层,进入到靠近基底层的上皮细胞尾端,注射器T4SS才能发挥作用,将毒性因子CagA注入上皮细胞[6]。在这个过程中,可以将黏连在一起的上皮细胞分开的丝氨酸蛋白酶HtrA发挥着重要的作用[6]。
HtrA对幽门螺杆菌的感染有重要作用
这一发现促使Backert开始思考,这个存在于所有幽门螺杆菌中的HtrA,是否会通过遗传变异影响幽门螺杆菌与胃癌之间的关系。
为了回答这个问题,Backert对1043个幽门螺杆菌菌株(分别来自胃癌、胃炎、无症状感染者和溃疡等疾病患者)的基因组进行了分析,他们筛选到3个与胃病密切相关的HtrA遗传变异,其中就包括位于蛋白酶结构域的171S/L。鉴于蛋白酶结构域对HtrA功能的重要性,他们将171S/L作为研究重点。
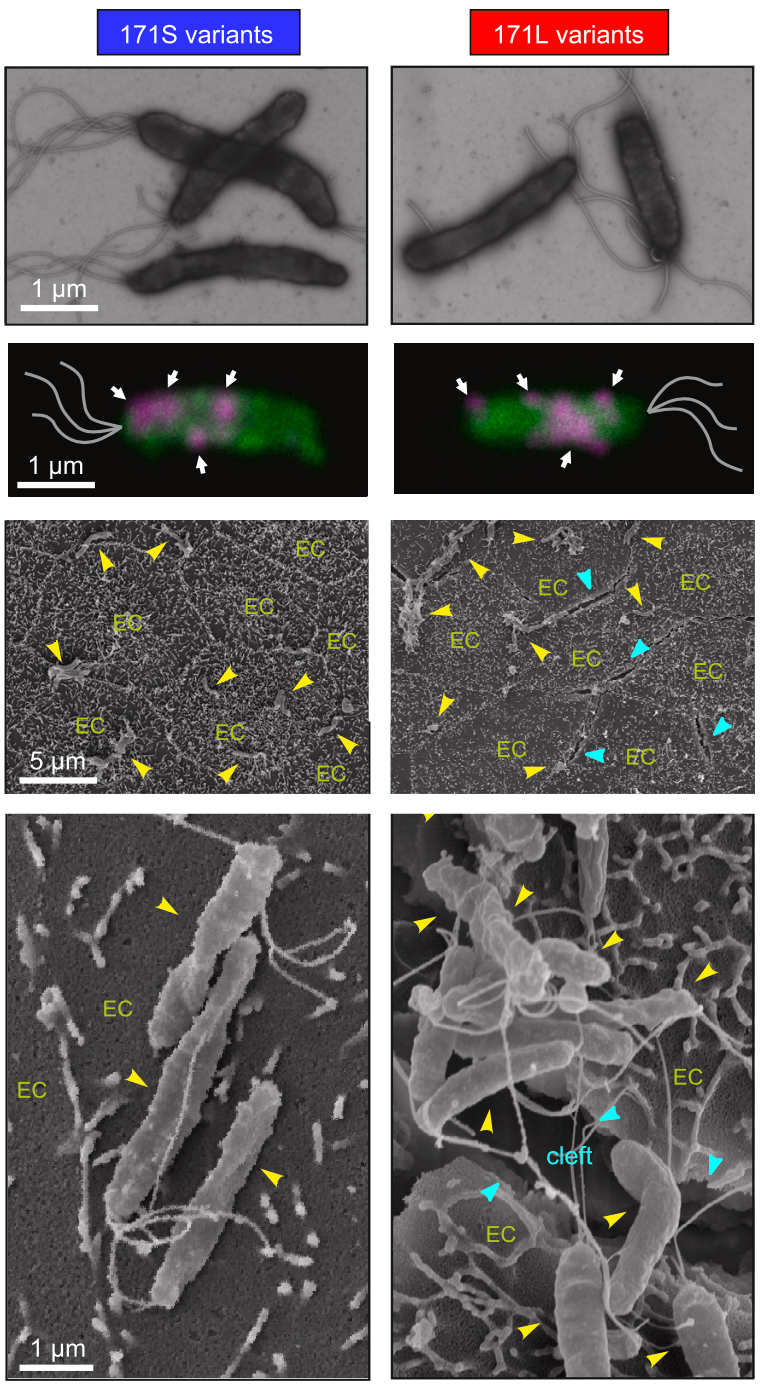
通过比较171S型和171L型HtrA之后,他们发现,来自胃炎样本的171S型HtrA大多以单体的形式存在,而来自胃癌患者样本的171L型HtrA则多为稳定三聚体,蛋白水解活性提高了3-5倍。不难看出,171L型HtrA分离胃上皮细胞的能力更强大。
进一步的分析显示,在171L型HtrA的存在下,黏连胃上皮细胞的E-粘连蛋白裂解水平更高,毒性因子CagA的注射也更强。显然,在活性更高的171L型HtrA三聚体帮助下,上皮细胞分的更开,幽门螺杆菌更容易地潜入了胃的近基底层部位,并将CagA注入胃上皮细胞。
171L型HtrA幽门螺杆菌导致上皮细胞之间的缝隙更大,进入基底侧的幽门螺杆菌更多
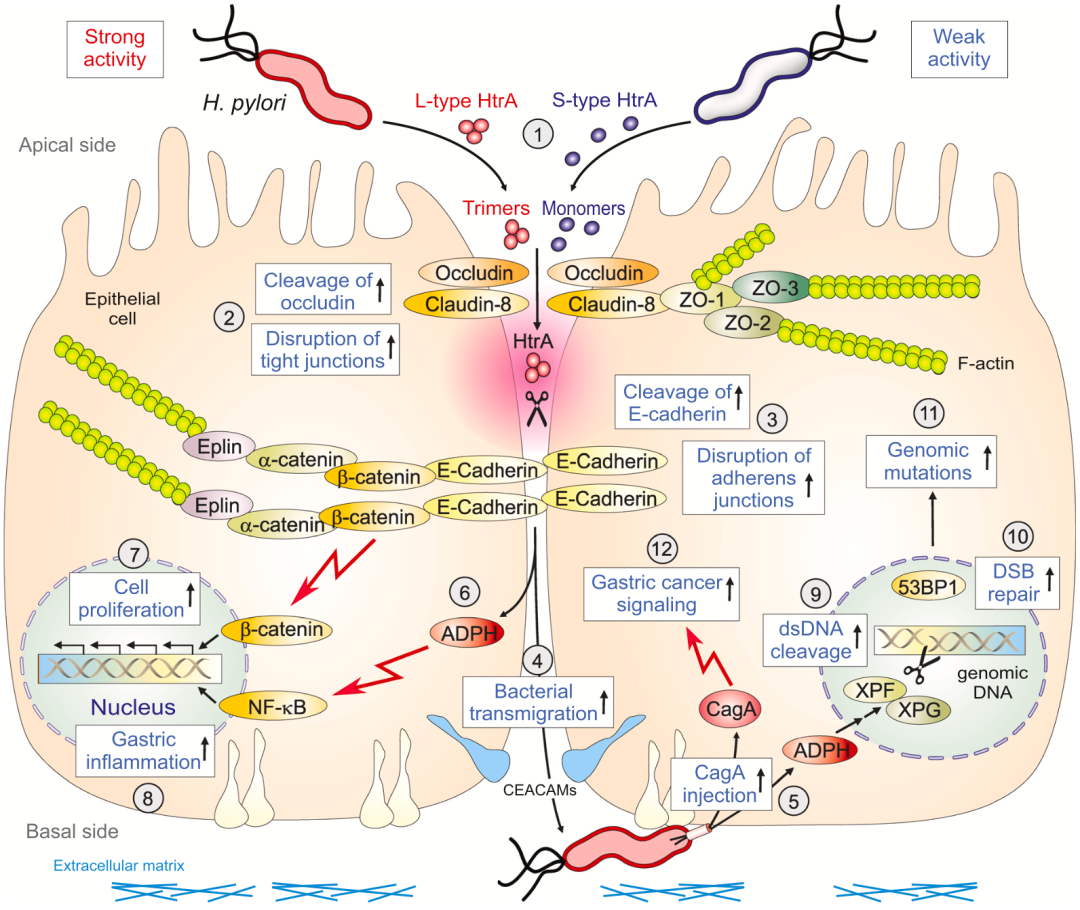
此外,从促炎的角度看,与171S型HtrA幽门螺杆菌相比,171L型HtrA幽门螺杆菌会增加促炎的NF-kB激活和促炎细胞因子IL-8的释放,以及增强了DNA的双链断裂和微核形成。这一系列的反应,会损害基因组的完整性,并增加有害突变的频率,最终导致上皮细胞恶变。
机制示意图
总的来说,Backert团队的这项研究表明,幽门螺杆菌丝氨酸蛋白酶HtrA的单核苷酸多态性(SNP)与胃癌的发生有关,尤其是171S/L与胃癌的发生显著相关。
这一成果属于首次发现并证实与胃癌发生相关的幽门螺杆菌SNP,为未来胃癌的预防找到了新的突破口。或许,在未来的幽门螺杆菌筛查中,可以通过引入HtrA的171S/L分型,判断感染者未来患胃癌的风险是否会大幅增加。
来自: 奇点网
更多阅读: