早期阿尔茨海默病(AD)的临床症状包括空间记忆力减退,抑郁和焦虑,这与大脑海马齿状回中,神经干细胞持续产生成体神经元(ABN)过程的损伤有关,这一过程通常被称为成人海马神经发生(AHN)。大量人体研究显示,AHN的水平在AD进展期间显著下降[1-3],但是否有办法在AD脑组织中增强AHN?如果可以的话,又是否有助于改善AD?这些仍是不明确的。
充实的/新的环境和运动等环境刺激可以增强AHN并且改善海马功能,但环境刺激的影响是广泛的,很难确定其中的关键信号通路机制。
2022年,北卡罗来纳大学教堂山分校Juan Song教授的研究团队发现,下丘脑的一个区域,乳头上核(SuM)对齿状回有丰富的投射,并且对神经源性刺激高度敏感,当动物暴露在新环境中时,SuM神经元放电频率、钙动力学和c-Fos表达增加,SuM神经元是新环境又到的AHN增强所必需的[4]。这意味着,刺激SuM或许是靶向增强AHN的新方法。
近日,Juan Song教授的团队在此基础上有了新发现!利用光遗传学技术刺激SuM可以在不同的AD模式小鼠中增强海马神经发生,随后再激活产生的ABN,成功改善AD小鼠的记忆和情感障碍,他们还发现,以上两个过程激活了突触可塑性和小胶质细胞的斑块吞噬作用,确定了介导AD临床症状改善的信号通路机制。研究结果发表在《细胞·干细胞》杂志上[5],第一作者为李亚东博士。
研究人员首先选择了5×FAD这种模式小鼠,从3.5月龄起,就开始出现轻度斑块沉积了,年龄越大越严重,而同窝的野生型小鼠则没有。和斑块病理同步,5×FAD小鼠AHN的损伤也开始于3.5月龄,4.5月龄时记忆受损,焦虑和抑郁样行为增加。
因此,AHN损伤确实发生在临床症状出现之前,这为靶向增强AHN以改善AD症状提供了前提,但是想要改善5×FAD小鼠的AD症状,必须满足“刺激SuM增强AHN”和“激活AHN增强后产生的ABN”这两个条件,根据研究人员的测试,只是刺激SuM或者只是激活已有的成体神经元,对5×FAD小鼠来说都没有用。
双管齐下之后,结果就不一样了。研究人员对3.5月龄小鼠的SuM神经元进行了32天的光遗传学刺激,相比无法接收光遗传学刺激信号的假手术对照组,实验组的神经前体细胞密度显著增加,神经元密度也有增加的趋势,ABN的树突棘(神经元间形成突触的主要部位)也显著增加,ABN和负责空间记忆的海马CA3区域神经元连接增加。
实验组小鼠AHN增强
在光遗传学刺激SuM神经元1天后,研究人员使用化学遗传学方法对AHN增强后的ABN进行了激活,实验组AD小鼠识别新物体的能力增强、对情景恐惧的学习和记忆能力增强,焦虑和抑郁样行为减少,AD小鼠的行为表现很快就恢复到了和同龄野生型小鼠相似的水平。
由于人类AHN水平低于小鼠,而AD患者还会更低,研究人员特意调整了化学诱导剂的剂量,使得他们只能“操纵”很小一部分ABN(~300 ABN/齿状回,<0.05%的总齿状回神经元),这一数量级与人类AHN具有可比性。因此,刺激SuM增强AHN+激活AHN增强后产生的ABN这种方法,即使只是一作用于小部分ABN,也可以对AD症状产生显著的影响。
5×FAD小鼠由于基因缺陷在较为年轻的时候就产生了斑块沉积,与散发性AD患者相比,缺少“衰老”这一关键推动因素,为此,研究人员在另一种AD模式小鼠3×Tg-AD小鼠中进行了重复实验,这种小鼠出现AD病理表现的时间要晚得多。在9月龄和15月龄的3×Tg-AD小鼠中,研究人员成功复刻了4.5月龄5×FAD小鼠的实验结果,证实了治疗方法的稳健性。
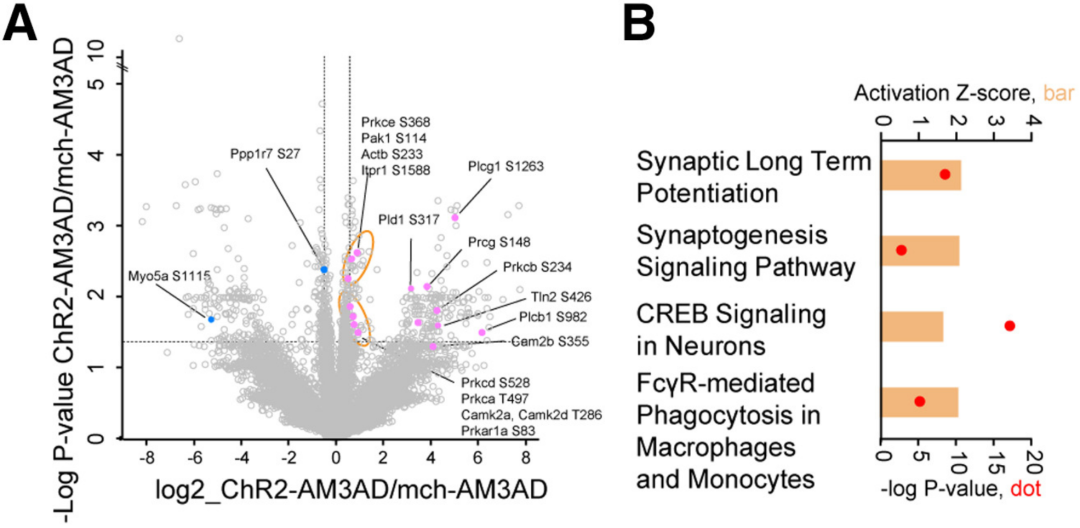
磷酸化蛋白质组学分析显示,和突触可塑性相关的通路被显著激活,包括长时程增强(LTP,两个神经元间信号传输的持久增强现象,是学习和记忆形成的主要分子机制之一)、CREB信号通路和突触发生等。
小胶质细胞的斑块吞噬作用相关通路也被显著激活,例如由FCγ受体介导的吞噬。AD会改变小胶质细胞的形态,细胞体面积增加,突起分枝减少,形态学指数增加,这些变化也在SuM增强的ABN激活后得到了逆转。
磷酸化蛋白质组学分析结果
总的来说,这项研究从AHN的角度出发,通过刺激SuM,增强AHN,再激活由此产生的ABN,改善了AD小鼠的记忆和情感障碍,这些改善与突触可塑性和小胶质细胞的斑块吞噬作用的增强有关。
研究团队透露,他们未来的工作计划集中在开发相关的靶向治疗方法上,希望能够在AHN水平低,甚至已经没有AHN的AD患者中发挥作用。
参考文献:
[1] Moreno-Jiménez E P, Flor-García M, Terreros-Roncal J, et al. Adult hippocampal neurogenesis is abundant in neurologically healthy subjects and drops sharply in patients with Alzheimer’s disease[J]. Nature medicine, 2019, 25(4): 554-560.
[2] Tobin M K, Musaraca K, Disouky A, et al. Human hippocampal neurogenesis persists in aged adults and Alzheimer’s disease patients[J]. Cell stem cell, 2019, 24(6): 974-982. e3.
[3] Terreros-Roncal J, Moreno-Jiménez E P, Flor-García M, et al. Impact of neurodegenerative diseases on human adult hippocampal neurogenesis[J]. Science, 2021, 374(6571): 1106-1113.
[4] Li Y D, Luo Y J, Chen Z K, et al. Hypothalamic modulation of adult hippocampal neurogenesis in mice confers activity-dependent regulation of memory and anxiety-like behavior[J]. Nature neuroscience, 2022, 25(5): 630-645.
[5] Li Y D, Luo Y J, Xie L, et al. Activation of hypothalamic-enhanced adult-born neurons restores cognitive and affective function in Alzheimer’s disease[J]. Cell Stem Cell, 2023, 30(4): 415-432. e6.
来自: 奇点神思
更多阅读: