微生物群-肠-脑轴的发现对于很多中枢神经系统(CNS)疾病来说无疑开辟了一条新的道路,因为肠道能够通过各种微生物来源的代谢物或肠道内分泌细胞产生和分泌的神经活性物质和激素来调节CNS的功能,参与中枢神经炎症过程。
神经、神经发育和精神障碍,包括轻度认知障碍(MCI)、帕金森病、阿尔茨海默病、多发性硬化症、自闭症谱系障碍和抑郁症,都与肠上皮屏障的形态学和功能变化有关,其中一些可能还与疾病严重程度有关[1-5]。
因此,对肠上皮屏障的全面认识将有助于帮助我们厘清其在CNS疾病中的作用和可靶向性。在最近的Lancet Gastroenterology & Hepatology杂志上,意大利比萨大学的研究团队发表了综述文章,全面概述了肠屏障在健康和CNS疾病中的作用,研究证据包括临床和基础研究结果,讨论了肠屏障改变在新的诊断和治疗策略方面有哪些影响[6]。
肠屏障的结构和功能
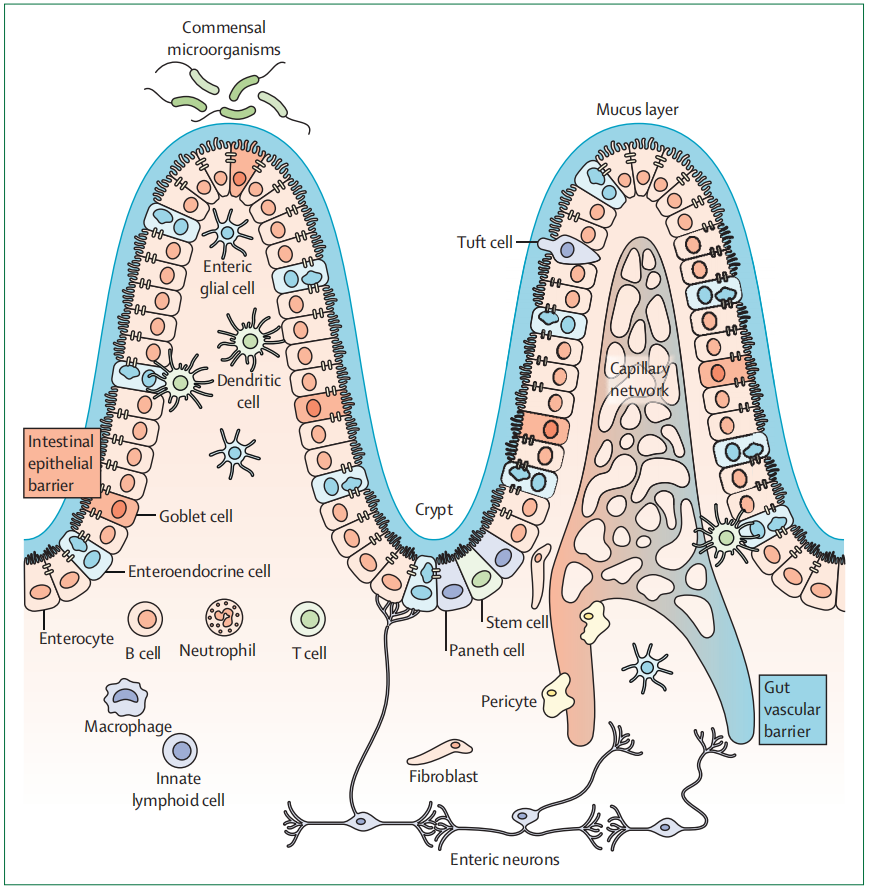
肠屏障包括黏液层、上皮屏障和肠道血管屏障,是一个多层网络,起到保护宿主免受外部伤害,及调节多种肠道功能的作用。
黏液层
黏液作为肠腔内内容物和肠上皮之间的物理屏障,调节肠道微生物群组成,吸收和分泌功能,以及肠道通透性。黏液还能调节肠道免疫反应。腺胃和结肠有双黏液层,内侧和外侧各有一层,小肠则只有单层,黏液主要由水和支链糖蛋白组成,其中最丰富的是黏蛋白,在人类中已经鉴定出20多种黏蛋白亚型,可分为跨膜黏蛋白和凝胶形成黏蛋白。
跨膜粘蛋白,包括MUC-1、MUC-3A、MUC-3B、MUC-4、MUC-12、MUC-13、MUC-15、MUC-17、MUC-20和MUC-21,合成后附着在肠细胞的细胞膜上,凝胶形成黏蛋白,包括MUC-2,由杯状细胞合成和分泌,杯状细胞的功能受到肠道微生物及其代谢物调节,尤其是短链脂肪酸。免疫细胞和炎症细胞也可以通过作用于杯状细胞来影响黏液的产生和分泌。
肠上皮屏障
肠上皮屏障在黏液层之下,由凸起的绒毛和凹陷的隐皮组成,包括肠细胞、杯状细胞、肠内分泌细胞、潘氏细胞、干细胞、簇状细胞和M细胞。这些细胞各司其职,分泌/吸收激素、抗菌肽、脂质和免疫球蛋白等多种物质。
簇状细胞作为一种罕见的上皮细胞,表达一些神经元标志物,参与肠脑通信和调节代谢。
肠上皮屏障的细胞通过连接复合物相互连接,维持屏障完整性,调节溶质和液体的细胞旁运输。Claudin蛋白是结构上紧密连接,产生膜内链的分子网络,将相邻的细胞连接在一起。屏障形成的claudin-1/3/4/5/8的减少和孔形成的claudin-2的增加是炎症性肠病中观察到的最明显的肠屏障异常,与屏障完整性丧失和通透性增加有关。
上皮细胞可以利用模式识别受体,如toll样受体(TLR)等,感知肠道微生物及其代谢物。这些受体的激活通过各种细胞内信号转导途径调节炎症反应和上皮屏障功能。在这些途径中,MYD88/NKκB通路受到特别关注,它可以在TLR4结合细菌膜脂多糖后,调节肠道紧密连接的通透性。特定的代谢物,如丁酸盐,也有助于维持肠道上皮屏障和宿主免疫的完整性。
肠道血管屏障
肠道血管屏障是肠屏障的最深层,调节肠道内容物进入体循环,进而到达远端器官。肠道血管屏障包括紧密和黏附连接在一起的内皮细胞、肠道胶质细胞、周细胞和成纤维细胞,共同维持肠壁内皮的完整性。
肠道微生物也参与肠道血管屏障的发展和保持,通过调节PECAM1和ANGPT1的表达来调节肠道内的血管生成。肠道微生物和肠道血管屏障的相互作用主要依赖于粘膜内皮细胞和间充质细胞上的TLR样和NOD样受体。
肠屏障的改变与CNS疾病之间的临床证据
在帕金森病、多发性硬化症、自闭症谱系障碍(ASD)、抑郁症/重度抑郁症、焦虑症、注意缺陷/多动障碍(ADHD)、MCI/主观认知能力下降(SCD)/阿尔茨海默病(AD)、强迫性神经失调、多系统萎缩症,以及精神分裂症中,均有临床研究证实,疾病的发生发展伴随肠屏障的改变,而且CNS疾病患者往往伴有胃肠道症状。
目前,人们已经充分认识到,帕金森病涉及到微生物-肠-脑轴,这也解释了为什么现有的大多数CNS疾病与肠屏障研究都是在帕金森病患者中进行的。
肠屏障的改变包括尿乳果糖/甘露醇比值增加,循环中ZO-1蛋白、脂多糖、claudin-5和肠脂肪酸结合蛋白水平升高。循环中结合珠蛋白水平升高与疾病的严重程度和持续时间有关。炎症标志物,包括TNF、IL-6、IL-1α和IL-1β等,水平升高,可能是由于微生物由肠道转移到血液中,在ASD、ADHD、抑郁症、多发性硬化症、MCI和AD中均有报道。
在精神分类症患者中,研究通过血浆IgM对紧密连接多成分响应的综合评分确认了肠屏障的功能失调,ASD患者的小肠活检也发现了屏障形成的claudin-1、闭合蛋白和MARVEL结合域蛋白2的RNA表达减少,孔形成的claudin-2/10/15的RNA表达增加。
总的来说,肠屏障的改变可以促进肠菌及其代谢物进入粘膜和血液,并扩散至大脑,激活肠道和循环中的免疫和炎症细胞,导致CNS炎症。
然而需要注意的是,许多问题仍然悬而未决,例如病理生理机制、因果关联,以及评估肠屏障损伤的方法。
肠屏障作为CNS疾病的治疗靶点的潜力
目前,研究人员正在尝试使用营养、植物化学或药理学策略来恢复和维持肠屏障完整性和通透性,以改善CNS疾病患者的症状,治疗方法包括益生元/益生菌、微生物代谢物、omega-3多不饱和脂肪酸、植物化学物质(齐墩果酸),以及选择性5-羟色胺受体4激动剂。
大多数现有的临床和临床前研究已经表明,调节肠道微生物对CNS疾病中肠屏障功能障碍的有益影响。
一项纳入了20例AD患者的研究显示,每日服用一次复合益生菌,28天后,参与者粪便结合珠蛋白水平下降,表明肠道通透性改善,但此研究缺乏随访、对照组和结合珠蛋白水平对应肠道通透性的临界值规定。
其他旨在评估肠道微生物对肠屏障功能障碍和CNS疾病进展影响的研究也已经在动物模型中进行,主要集中在益生元/益生菌在AD或多发性硬化症中。这些研究表明,长期治疗能够增加AD或实验性自身免疫性脑脊髓炎(EAE,模拟人类多发性硬化症)小鼠肠道紧密连接、增加结肠黏液细胞,或改善肠道通透性来减轻肠屏障损伤。肠道微生物组成的重塑伴随着大脑中病理变化的延迟,认知和运动功能损伤减轻。
值得注意的是,益生菌治疗也减轻了与CNS疾病相关的肠道和CNS的免疫和炎症反应。

在ALS小鼠中,丁酸盐补充恢复了小鼠肠道微生物稳态、肠屏障的完整性和通透性,以及紧密连接形态和潘氏细胞的数量。
植物化学物质的代表,齐墩果酸是一种具有抗氧化、抗炎、抗菌和神经保护特性的三萜,通过改善了EAE小鼠肠道内氧化应激、炎症和肠道通透性,保持杯状细胞中黏蛋白水平。
综上所述,目前的研究证据表明,一些化合物可以通过改善肠屏障完整性和通透性,在CNS疾病中发挥有益作用。不过,还是需要进一步的研究来更好地阐明微生物、肠屏障、免疫和炎症系统以及微生物-肠-脑轴之间相互作用的机制。
此外,尽管一些临床试验已经显示出了益生菌对CNS疾病患者的有益作用,但目前尚无证据表明微生物调节对人类肠屏障的影响,需要进行相应试验,将肠道微生物组成/丰度的改善-肠道屏障完整性-CNS疾病进展延迟串联起来。
虽然从现有的研究证据来看,肠屏障功能障碍可能是CNS疾病的共同途径,但肠屏障受损和大脑病理改变之间的因果关系仍有待澄清。另外,肠道血管屏障在CNS疾病中的作用的研究也很缺乏,作为肠屏障功能生物标志物的分子也尚未达成共识。这些都需要在未来的研究中得到改进,并且探索更多的可以改善肠屏障,干预CNS疾病进展的治疗策略,如干细胞、生长因子和结合珠蛋白抑制剂等。
参考文献:
[1] Wang X, Liu G J, Gao Q, et al. C‐type lectin‐like receptor 2 and zonulin are associated with mild cognitive impairment and Alzheimer’s disease[J]. Acta Neurologica Scandinavica, 2020, 141(3): 250-255.
[2] Stevens B R, Goel R, Seungbum K, et al. Increased human intestinal barrier permeability plasma biomarkers zonulin and FABP2 correlated with plasma LPS and altered gut microbiome in anxiety or depression[J]. Gut, 2018, 67(8): 1555-1557.
[3] Esnafoglu E, Cırrık S, Ayyıldız S N, et al. Increased serum zonulin levels as an intestinal permeability marker in autistic subjects[J]. The Journal of pediatrics, 2017, 188: 240-244.
[4] Camara-Lemarroy C R, Silva C, Greenfield J, et al. Biomarkers of intestinal barrier function in multiple sclerosis are associated with disease activity[J]. Multiple Sclerosis Journal, 2020, 26(11): 1340-1350.
[5] Forsyth C B, Shannon K M, Kordower J H, et al. Increased intestinal permeability correlates with sigmoid mucosa alpha-synuclein staining and endotoxin exposure markers in early Parkinson’s disease[J]. PloS one, 2011, 6(12): e28032.
[6] Pellegrini C, Fornai M, D’Antongiovanni V, et al. The intestinal barrier in disorders of the central nervous system[J]. The Lancet Gastroenterology & Hepatology, 2022.
来自: 奇点神思
更多阅读:


