深脑电刺激(DBS)被形象地称为“脑起搏器”。
植入大脑深部的电极发出的电脉冲,可以改变相应神经元兴奋性。DBS已经用于帕金森病(PD)、癫痫以及梅杰综合征等疾病的治疗[1]。然而,DBS的植入毕竟还是需要进行颅脑手术,患者需要承担手术相关并发症的风险。
虽然一些学者提出了潜在的替代疗法,如光遗传学、磁热疗法以及磁电疗法等[2-4],但非特异的基因插入以及高温对非靶区组织的损伤,仍是需要解决的问题。因此,若能开发一种非侵入性、更安全的神经刺激疗法,对于PD等神经功能障碍患者的临床治疗将具有重大意义。
近日,来自韩国浦项科技大学的Won Jong Kim团队在《自然·生物医学工程》杂志发表重磅研究成果[5]。他们开发了一种可用于刺激大脑深部组织的压电纳米颗粒,该纳米颗粒在聚焦超声作用下可释放一氧化氮,从而打开血脑屏障并进入脑实质,同时可由超声诱导产生压电效应,从而发出电流刺激多巴胺能神经元释放多巴胺,缓解PD模型小鼠的症状,同时无明显的毒副作用。
这种纳米颗粒使非侵入性、安全地对脑内靶区实行电刺激成为现实,PD等神经退行性疾病有望迎来新疗法。
论文首页截图
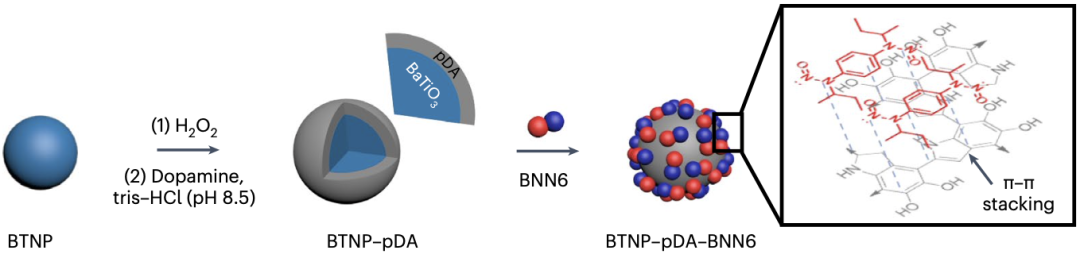
Kim团队使用的压电颗粒被称为BTNP–pDA–BNN6,BNN6是一种可在超声刺激下释放一氧化氮的材料,BTNP是一种直径为200纳米的压电钛酸钡纳米颗粒,是BNN6的载体。pDA(聚多巴胺)为包被在BTNP表面的具有胶体稳定性、导电性和生物相容性的涂层,用以连接BNN6和BTNP。
BTNP–pDA–BNN6结构示意图
Kim团队首先验证了该纳米颗粒是否可以在超声作用下释放出一氧化氮。结果显示,与没有超声波作用时相比,在超声波(490W,40kHz,5.2W/cm²)作用下BNN6可从BTNP表面分离,并释放出更多的一氧化氮,且不影响材料的压电特性。
在超声波作用下BTNP–pDA–BNN6可释放出一氧化氮
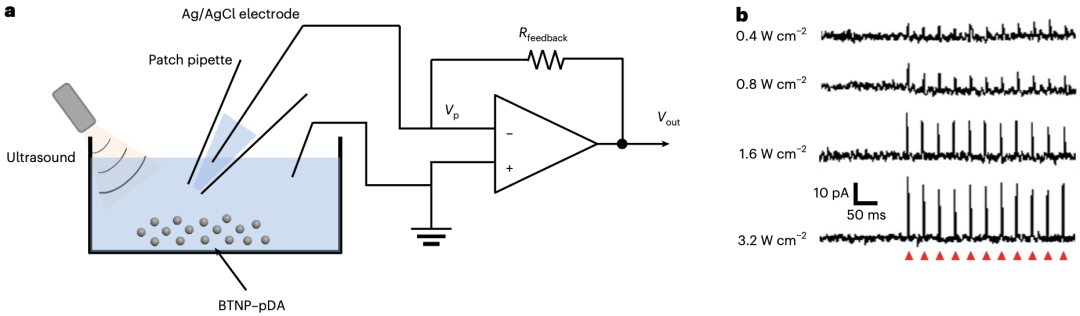
紧接着,他们利用膜片钳技术检测了BTNP–pDA在生理条件下的超声诱导压电效应,发现BTNP-pDA可产生与超声强度呈正比的电流。
此外,BTNP–pDA可在超声作用下引起脑切片中兴奋性突触后电流的强度和频率升高,对神经元的兴奋性起到调控作用。这些结果表明BTNP–pDA的压电特性可在超声作用下对神经元进行电刺激。
BTNP-pDA可产生与超声强度呈正比的电流
DBS的作用机理被认为是电刺激打开了神经元细胞膜上的Ca2+离子通道,使突触中神经递质加速释放,从而起到治疗作用[6]。BTNP–pDA–BNN6的作用机理在理论上与DBS相似。
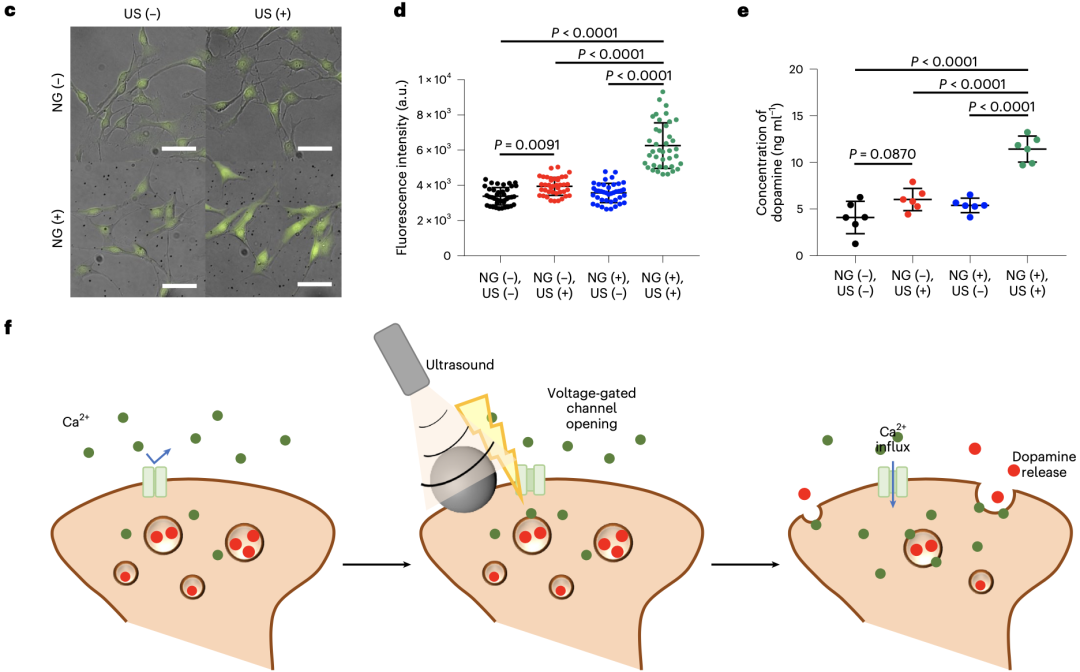
通过对SH-SY5Y细胞(神经母细胞瘤来源的神经元样细胞)Ca2+离子动态变化的记录,Kim团队证实了在声强为0.4W/cm²的超声(对细胞间连接、生长、活性无明显影响)及BTNP–pDA–BNN6作用下,SH-SY5Y细胞内的钙离子浓度明显增加,而在单独超声或纳米颗粒的作用下,细胞内的钙离子浓度则无明显变化。
同时,与钙离子浓度变化一致,在超声及BTNP–pDA–BNN6作用下,细胞培养液内多巴胺浓度也升高,而加入钙离子螯合剂后,培养液内的多巴胺浓度变化消失,表明多巴胺浓度的升高的确是由于超声及BTNP–pDA–BNN6作用下细胞内钙离子浓度升高所致。
超声及BTNP–pDA–BNN6作用下SH-SY5Y细胞内的钙离子浓度明显增加,且培养液内的多巴胺浓度升高
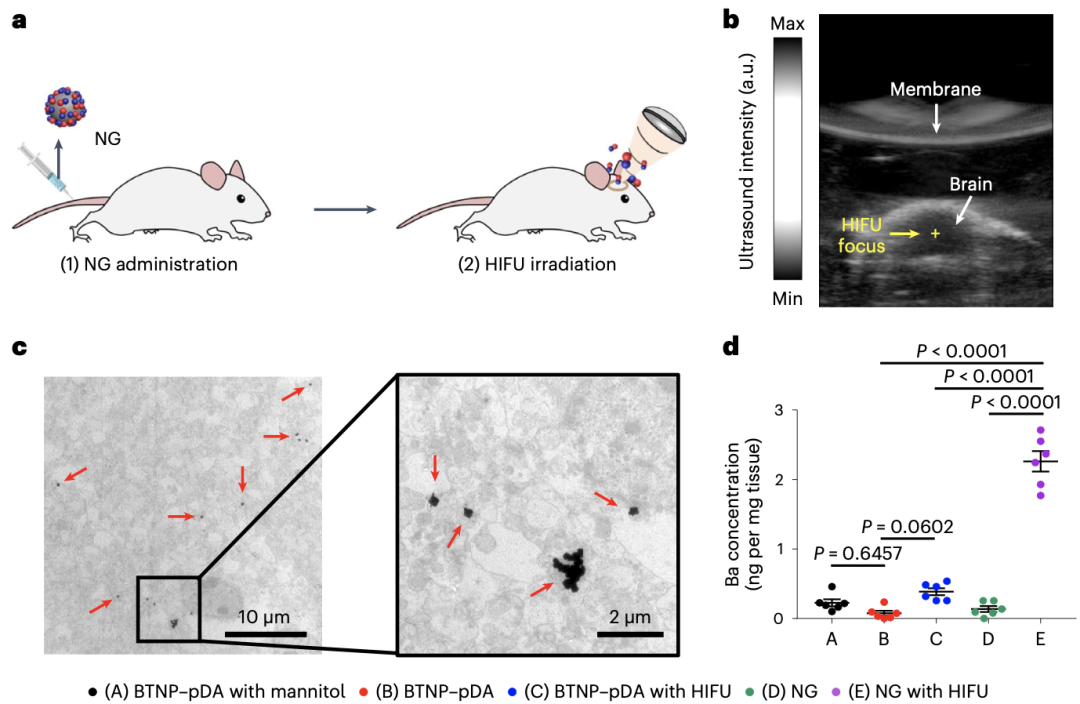
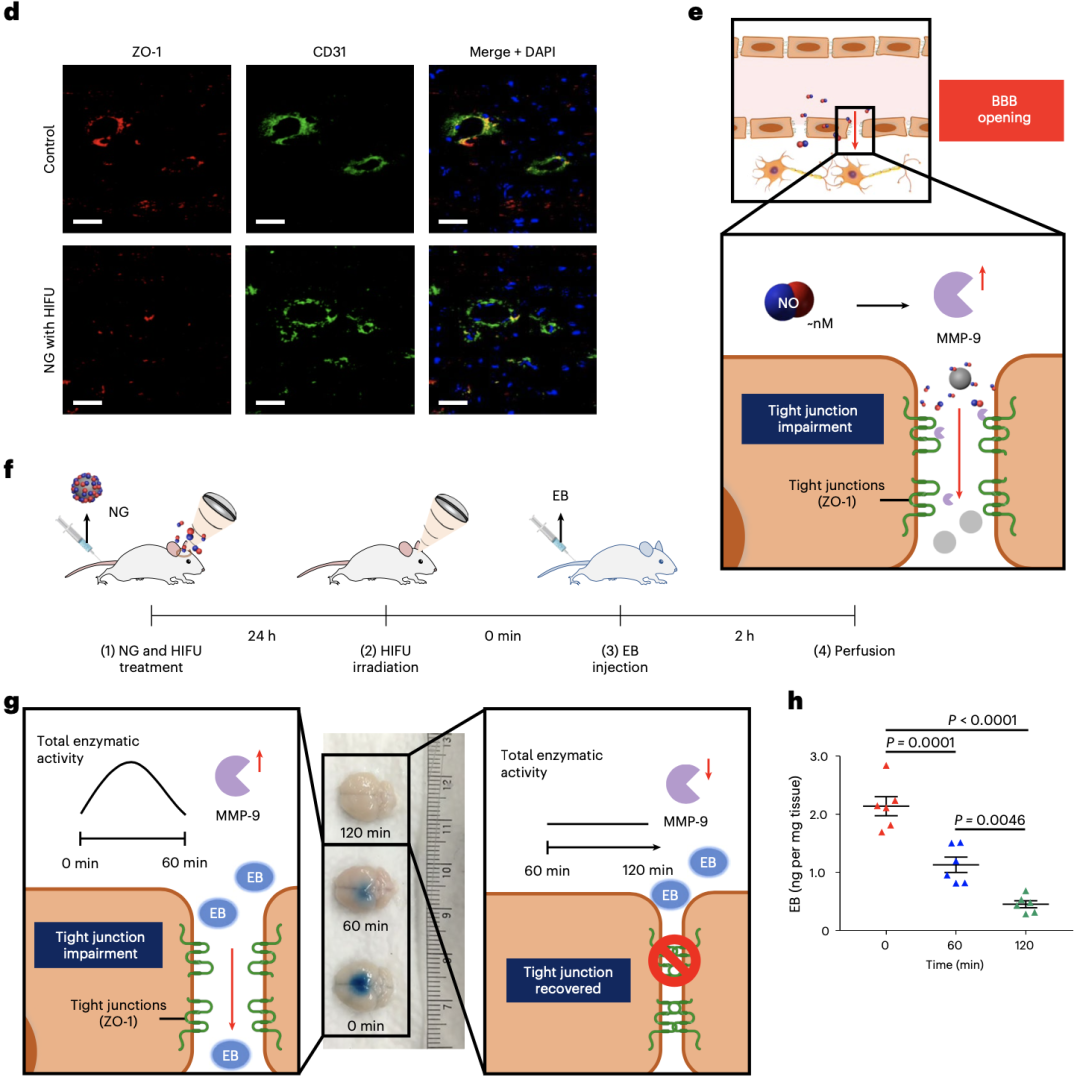
脑部给药最大的障碍就是血脑屏障,Kim团队发现BTNP–pDA–BNN6可以通过释放一氧化氮来打开血脑屏障。在给小鼠注射BTNP–pDA–BNN6,并使用高强度聚焦超声处理,可以观察到小鼠脑实质中纳米颗粒的浓度显著升高。
超声作用后该纳米颗粒通过释放一氧化氮来打开血脑屏障
随后,Kim团队探究了该纳米颗粒打开血脑屏障的机制。经过研究发现,BTNP–pDA–BNN6释放的一氧化氮可显著升高基质金属蛋白酶-9(MMP9)的表达水平,从而降解紧密连接蛋白ZO-1,进而打开血脑屏障。
此外,他们还通过实验证实,BTNP–pDA–BNN6释放一氧化氮后造成的血脑屏障打开并不是永久的,大约在2小时之内,血脑屏障会重新关闭。这对防止血脑屏障永久性破坏可能造成的缺血性卒中、神经炎症和神经退行性疾病等至关重要。
BTNP–pDA–BNN6释放一氧化氮后造成的血脑屏障打开机制,且血脑屏障的打开是可逆的
接下来就是整个研究最关键的步骤了。
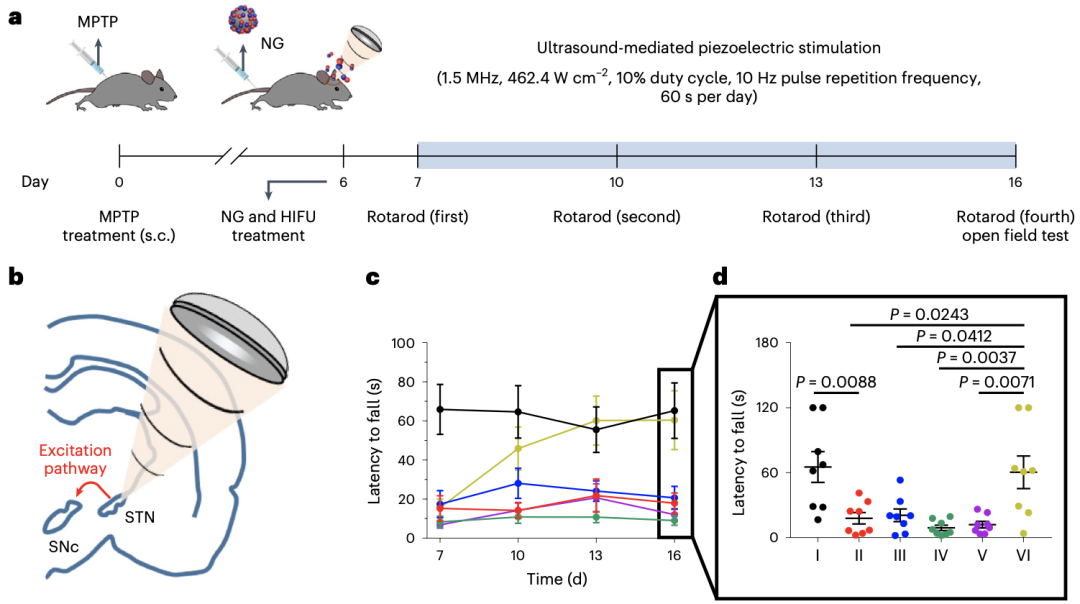
Kim团队给PD小鼠模型(通过MPTP诱导)注射了BTNP–pDA–BNN6,然后靶向丘脑底核进行高强度聚焦超声作用。
结果显示,该区域神经元被明显激活,并使得其下游(尤其是背侧纹状体细胞外)多巴胺水平明显升高,从而改善了PD小鼠的运动症状。在连续10天的超声及BTNP–pDA–BNN6作用下,PD小鼠转棒实验的成绩明显提高。
超声联合BTNP–pDA–BNN6可有效改善PD小鼠运动症状
Kim团队还发现超声联合BTNP–pDA–BNN6作用减少了黑质中多巴胺能神经元的死亡,这同样可起到减轻PD症状的作用。
最后,他们评估了超声联合BTNP–pDA–BNN6作用是否具有明显的毒副作用。通过对小鼠血液样本、脑组织以及心、肝、肺、脾、肾等进行活检,他们并未发现该疗法具有明显的毒副作用。
总的来说,Kim团队开发了一种非侵入性、安全性很高的压电纳米颗粒BTNP–pDA–BNN6,该颗粒不仅可在超声作用下释放一氧化氮,可逆地打开血脑屏障,而且可以在超声作用下对靶区产生电刺激,进而对如PD等疾病起到治疗作用,是一种具有重要潜在应用价值的无创疗法。
参考文献
1.Okun MS: Deep-brain stimulation for Parkinson’s disease. N Engl J Med 2012, 367(16):1529-1538.
2.Chen R, Romero G, Christiansen MG, Mohr A, Anikeeva P: Wireless magnetothermal deep brain stimulation. Science 2015, 347(6229):1477-1480.
3.Guduru R, Liang P, Hong J, Rodzinski A, Hadjikhani A, Horstmyer J, Levister E, Khizroev S: Magnetoelectric ‘spin’ on stimulating the brain. Nanomedicine (Lond) 2015, 10(13):2051-2061.
4.Chen S, Weitemier AZ, Zeng X, He L, Wang X, Tao Y, Huang AJY, Hashimotodani Y, Kano M, Iwasaki H et al: Near-infrared deep brain stimulation via upconversion nanoparticle-mediated optogenetics. Science 2018, 359(6376):679-684.
5.Kim T, Kim HJ, Choi W, Lee YM, Pyo JH, Lee J, Kim J, Kim J, Kim JH, Kim C et al: Deep brain stimulation by blood-brain-barrier-crossing piezoelectric nanoparticles generating current and nitric oxide under focused ultrasound. Nat Biomed Eng 2022.
6.Kringelbach ML, Jenkinson N, Owen SL, Aziz TZ: Translational principles of deep brain stimulation. Nat Rev Neurosci 2007, 8(8):623-635.
来自: 奇点神思
更多阅读: