美人迟暮,将军残年,先扬后抑的悲剧戏码永远深受青睐。
人类的悲欢或许各不相通,但上到耄耋,下至弱冠,皱纹肆虐和体能渐弛总能一石激起千层浪。
对于衰老感到恐慌吗?是!能坚持锻炼并控糖控脂吗?不能!
有年龄焦虑的小朋友们吱一声嘞,提起健康生活,你们的减肥计划、抗老行动是不是经常就此搁浅?
其实,推迟容颜与体态衰老只是提倡健康生活的冰山一角,调动机体免疫系统的活力以及延缓人体免疫衰老才是底牌。
近日,德国柏林夏里特医学院的Joachim Spranger团队,在Microbiome杂志上发表重要研究成果。他们发现,热量限制通过影响肠道菌群可改善代谢健康,并延缓免疫衰老[1]。
论文首页
从生理角度看,衰老就是一种由生物体新陈代谢减退引发的自然规律,表现为结构的退行性改变以及生物体机能衰退。事实上,衰老机制盘根错节,难以辨明。
《自然》最新一项研究报道,衰老的免疫细胞会加速其他器官衰老,对系统性衰老可能有重要推动作用[2-3]。
那么,我们就先了解一下何为免疫衰老。
简单来说,年轻时的免疫系统宛若守卫人体防线的少年将军,可谓是“火眼金睛”,杀伐果断。而免疫衰老就是“将军暮年”的真实写照,明察秋毫熬成了“老眼昏花”,不仅丧失防御外敌、清除异体和建立保护的能力,还有“倚老卖老”之嫌,立于前线衰而不退(外周组织记忆细胞比例持高),导致大本营无法“调兵遣将”(骨髓、胸腺中幼稚T细胞和B细胞增殖抑制)。
数万亿微生物定植于胃肠道,维持着宿主代谢稳态,既能调节脂肪组织扩增和葡萄糖代谢,又能塑造宿主免疫系统[4-7]。不过,肠道菌群可不是一成不变,相反,其始终处于高度动态变化的状态,而饮食是驱动肠道菌群结构和活性变化最强的因素之一,热量摄入、饮食干预以及饮食诱导的肥胖对肠道菌群的动态变化均有影响[8-10]。
同时,有关肥胖与炎症的报道相继问世。研究指出,肥胖与全身性和脂肪组织的炎症密切相关,通常伴有促炎性T细胞和记忆B细胞的浸润,后者可通过招募趋化因子加剧炎症[11-13]。此外,肥胖相关的慢性炎症还会促使免疫衰老,而限制热量摄入可有效延迟这个过程[14-15]。
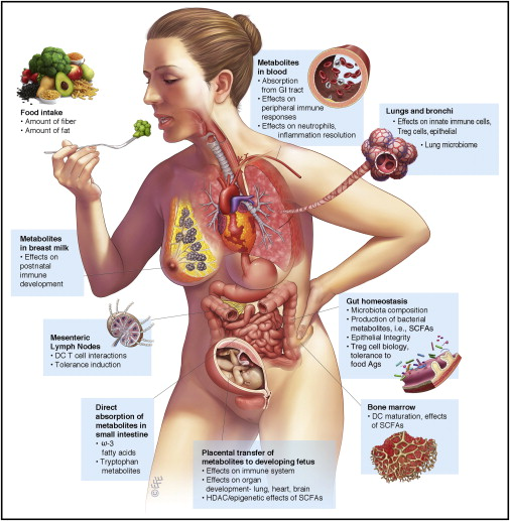
饮食或细菌代谢物与免疫系统相互作用的要点概览[16]
由此可见,热量限制在肠道菌群改变与炎症发展之间扮演着关键的角色,但饮食驱动的肠道菌群改变对宿主免疫的具体影响尚未阐明,针对此,Spranger团队进行了深入研究。
他们从一项减肥干预研究中收集粪便样本,用于粪便微生物群转移(FMT)实验。这项研究干预组的标准减肥计划共计12周,前8周属于热量限制期,以极低卡路里饮食(VLCD, 800 kcal/d)代替所有膳食饮食。在VLCD治疗前后,研究人员从减肥效果最好的前5名女性中提取了粪便样本用于后续实验研究与分析。
Spranger团队将无菌C57BL/6J小鼠随机分成三组,以不做任何处理的无菌小鼠作为对照,接受VLCD治疗前FMT的小鼠定为AdLib组,接受VLCD治疗后FMT的小鼠定为CalRes组。
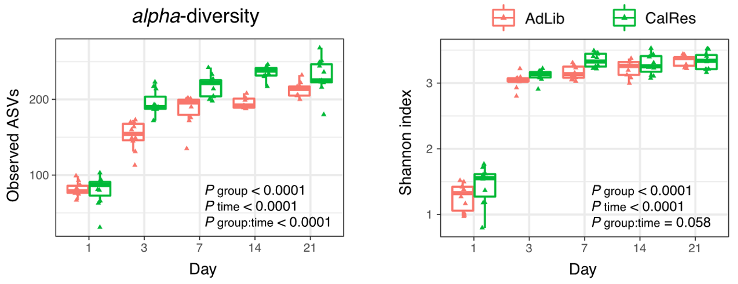
首先,Spranger团队对各组小鼠粪便样本进行了16S rRNA基因测序,以确定组间肠道菌群的差异。结果显示,与AdLib组相比,CalRes组肠道菌群表现出更高的整体α多样性,同时,与肥胖有关的红螺菌丰度显著减少。
FMT定植三周内肠菌丰富性与多样性的扩增子序列变异(ASV)和Shannon指数
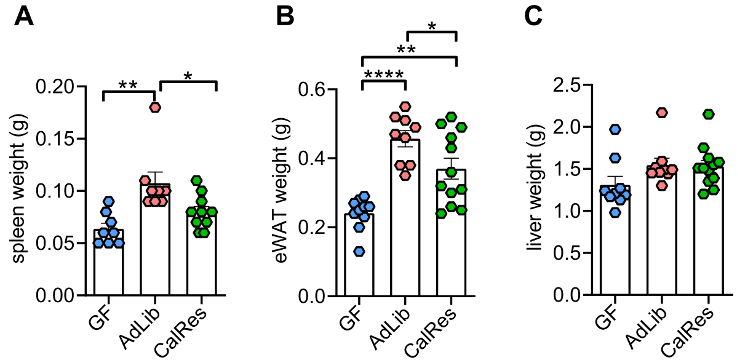
接下来,Spranger团队评估了肠菌定植对小鼠肥胖和葡萄糖代谢的影响。他们发现,接受人类肠菌定植后,小鼠表腺白脂肪组织(eWAT)、脾脏和肝脏的重量均会增加,但CalRes组小鼠eWAT的重量比AdLib组的明显轻,说明热量限制有利于减少脂肪组织。
各组小鼠脾脏、eWAT和肝脏的重量
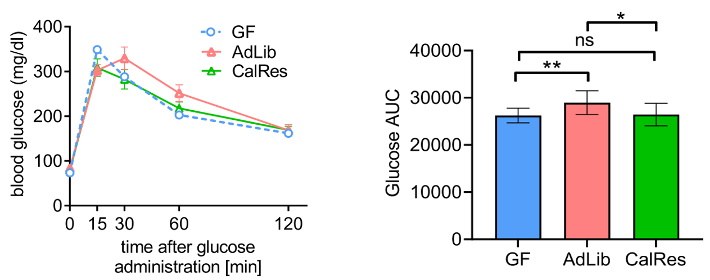
此外,口服葡萄糖耐量试验结果显示,CalRes组小鼠体内葡萄糖随时间推移趋于较低的水平,与AdLib组相比,其葡萄糖–时间曲线下面积显著减少,表明限制热量摄入诱导的肠道菌群改变可能有利于改善代谢健康。
空腹GF小鼠和接受定植且正常饮食小鼠血液中的葡萄糖水平
探究肠道菌群改变对代谢的影响只是开胃菜,在此基础上,Spranger团队对肠菌改变与宿主免疫系统之间的关系展开了研究。
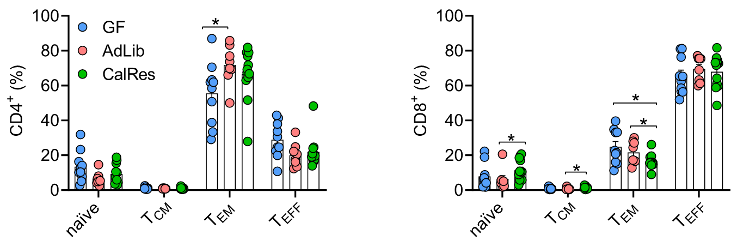
肠菌定植三周后,研究员们绘制了各组小鼠结肠免疫细胞的t-分布邻域嵌入算法(t-SNE)图谱,并进行了统计分析以比较适应性和固有免疫细胞中不同亚群的水平。他们发现,AdLib微生物群的定植提高了CD4+效应记忆T细胞(TEM)比例,而CalRes微生物群的定植增加了幼稚CD8+T细胞的比例,同时,CD8+效应记忆T细胞水平降低。
各组小鼠结肠中CD4+T细胞与CD8+T细胞不同亚群的水平
备注:naïve即幼稚细胞,TCM即中央记忆T细胞,TEM 即效应记忆T细胞,TEFF即终末分化效应记忆T细胞
在B细胞的亚群分析中发现了类似的结果。接受CalRes微生物群定植的小鼠结肠中B细胞总体比例明显增加,其中,幼稚B细胞水平提高,而记忆B细胞水平降低。
此外,与无菌小鼠相比,定植小鼠组的NK细胞比例均有降低,但CalRes组小鼠结肠中活化的NK细胞比例显著增加。这些结果表明,饮食诱导的肠菌改变可调控结肠中效应记忆T和B细胞的水平,有效延缓结肠中免疫细胞衰老。
各组小鼠结肠中B细胞亚群的水平
结肠免疫细胞水平的改变毕竟只是局部情况,为揭示系统性免疫细胞的变化,Spranger团队对脾脏中的免疫细胞亚群做了分析。
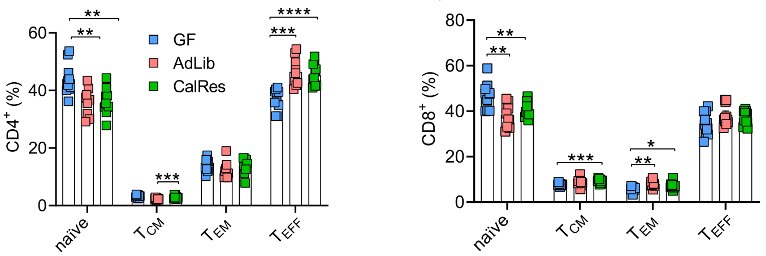
结果显示,接受人类肠菌定植的小鼠脾脏中幼稚CD4+和CD8+ T细胞总体水平降低,不受热量限制的影响,而CD4+ TEFF亚群及CD4+ TEM亚群的水平明显增加,CD8+ TCM和TEM两个亚群的比例也有所提高。
上述结果表明,热量限制诱导的肠菌改变确实会影响全身适应性和固有免疫细胞水平,但对延迟脾脏免疫细胞衰老的效果并不明显。
各组小鼠脾脏中CD4+ T细胞与CD8+ T细胞不同亚群的水平
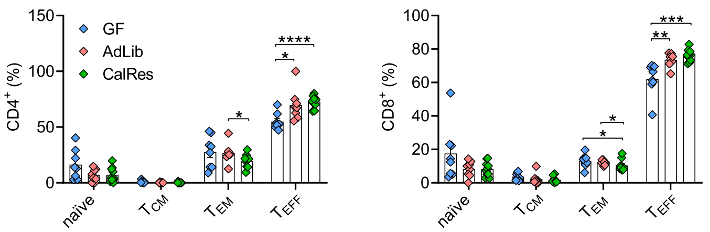
随后,Spranger团队探究了肠菌改变对肝脏免疫细胞组成的影响。结果显示,与无菌小鼠相比,接受CalRes微生物群定植显著降低了小鼠肝脏中CD4+和CD8+ TEM亚群的水平。
同时,幼稚B细胞水平下降,而记忆B细胞水平增加。这些结果表明,CalRes微生物群可以有效推迟肝脏中T细胞衰老,但对延缓B细胞衰老的效果不明显。
各组小鼠肝脏中CD4+ T细胞与CD8+ T细胞不同亚群的水平
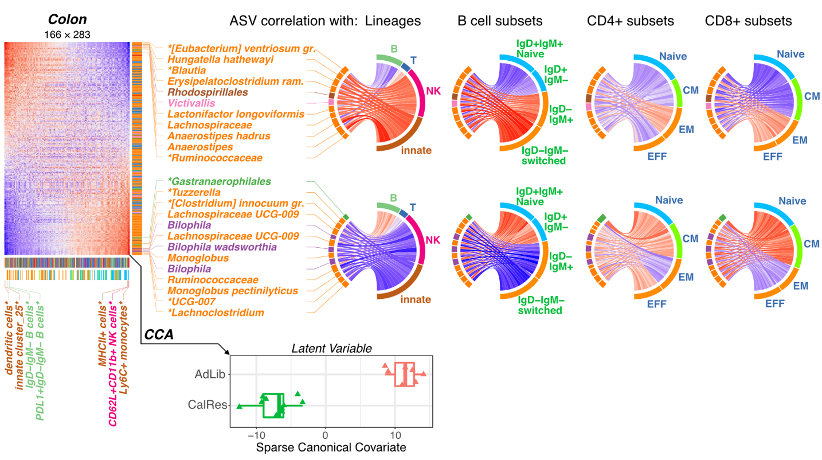
最后,研究员们对免疫细胞亚群与肠道微生物改变之间的显著相关性进行了验证。
他们发现,CalRes相关菌群与幼稚CD4+和CD8+ T细胞、CD4+ 和CD8+ T中央记忆细胞亚群,以及幼稚B细胞亚群呈正相关,而AdLib组丰度较高的肠菌与结肠中转化B细胞、记忆T细胞和效应T细胞亚群呈正相关,表明热量限制对多个器官免疫衰老的推迟可能依赖于肠道菌群的改变。
粪便样本中ASVs与结肠中所有免疫参数之间的潜在相关性矩阵
综上所述,这项研究对热量限制条件下宿主免疫系统与肠道菌群之间的相互作用进行了系统研究,成功证明限制热量摄入对肠菌的改变有利于延迟宿主免疫衰老。
不过,该项研究也存在一些局限。
首先,定植的粪便样本来自人类单独个体,可能难以推广至其他个体,因此,受体的免疫反应可能因供体个体微生物群落动力学的改变而改变。其次,探究热量限制对免疫系统的影响涉及人类供体到小鼠受体的转化,这种间接数据可能干扰最终结果,例如,CalRes组脾脏中免疫细胞的分析结果并未呈现出衰老延迟的趋势。最后,小鼠不是单独饲养,而是以每笼2-4只小鼠分组,这可能与少数肠道菌群的丰度分布偏斜有关。
总体而言,这项研究成果首次提供了热量限制条件下宿主免疫系统与肠道菌群之间相互作用的数据,也为今后饮食与代谢性疾病(肥胖和2型糖尿病)的研究提供了新思路。
来自: 奇点网
更多阅读: