肠菌不仅会帮助我们消化食物,还会促进肠道将食物残渣中的营养物质吸收的“干干净净”。
近日,由浙江大学王宇浩和美国西南医学中心Lora Hooper领衔的研究团队,在顶级期刊《科学》上发表了一项重要研究成果[1]。
他们发现,肠道中的髓样细胞在感知到肠道微生物的存在之后,会通过一长串信号通路,促进肠道对脂肪的吸收和代谢,导致小鼠长胖[1]。如果清除小鼠肠道中的微生物,或者直接阻断上面的信号通路,就会阻碍肠道吸收脂质,导致脂质通过粪便排除;还会降低小鼠的体脂,或预防高脂饮食导致的肥胖。
更重要的是,在这个研究中,他们在肠道细胞中发现了肠菌调控脂质吸收的关键基因Snhg9,它编码一个长非编码RNA(lncRNA)。肠菌的存在会导致Snhg9低表达,肠道脂质吸收增强,小鼠容易长胖;无菌小鼠或Snhg9过表达小鼠,肠道脂质吸收受损,小鼠不容易发胖。
因此,Snhg9或许是预防或治疗代谢相关疾病的新靶点。据了解,这也是科学家首次发现并证实长非编码RNA Snhg9在肠菌调控宿主脂质代谢过程中起到关键作用。
论文首页截图
肠菌组成与宿主的胖瘦密切相关,现在应该尽人皆知了。
但是科学家在实验室饲养小鼠的时候,有个更直观的发现。那就是与普通小鼠相比,那些无菌小鼠往往更瘦,而且吃西式高脂饮食也不容易胖起来。
为了搞清楚背后的原因,王宇浩和他的同事们就对常规饲养小鼠和无菌小鼠的肠道上皮细胞做了全转录组RNA测序,看看这两类小鼠的肠道究竟有哪些差异。
他们发现了很多差异表达的基因,不过在本研究中,他们将重点放在了编码长非编码RNA的基因上,结果Snhg9就浮出水面了。与无菌小鼠相比,有菌小鼠肠道中Snhg9的水平下降最多。其他实验方法得出的数据,也证实了在有菌的情况下,肠道Snhg9表达大幅下降。
Snhg9浮出水面
随后,王宇浩等人研究了Snhg9的功能。
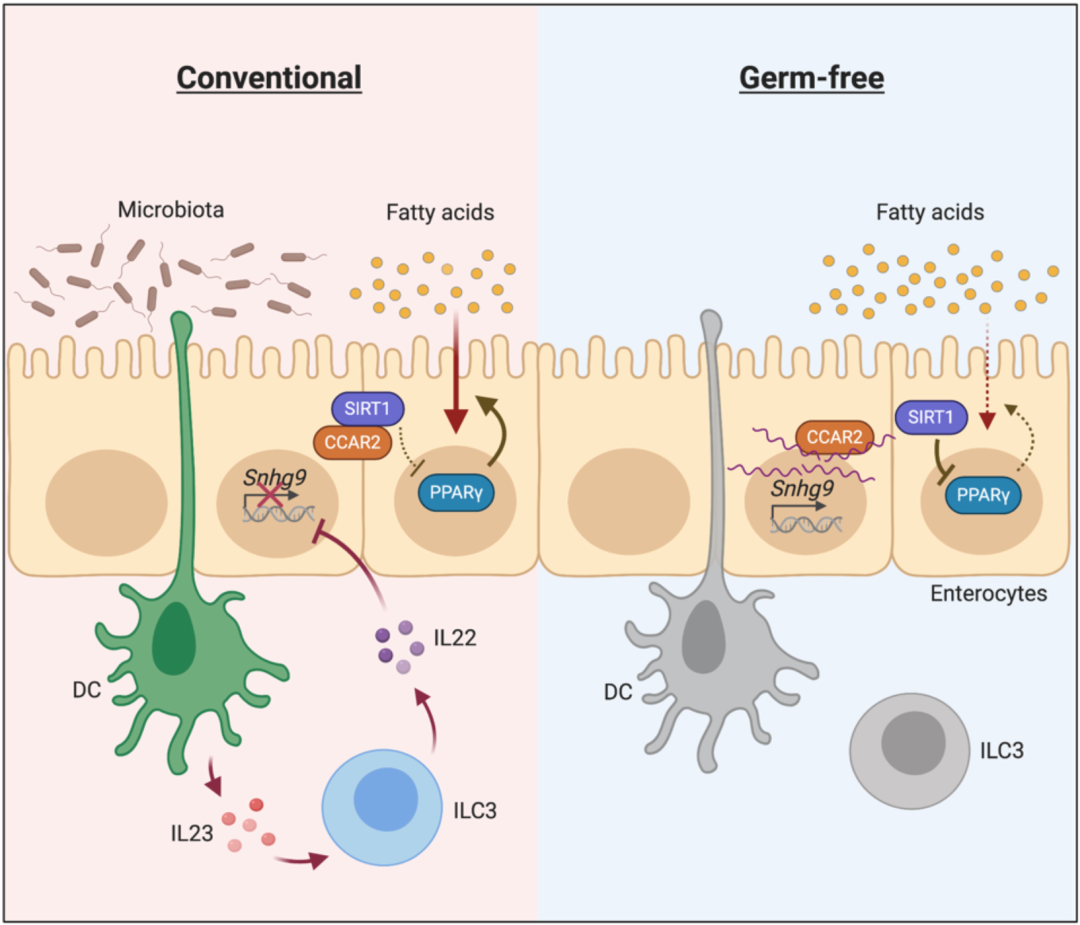
他们发现,Snhg9能直接与一个叫做CCAR2的蛋白结合,而CCAR2又是去乙酰化酶sirtuin1(SIRT1)的内源抑制剂。重要的是,Snhg9与CCAR2的结合,会导致SIRT1活性增强。
这个SIRT1也不简单,它可以通过两种方式抑制转录因子PPARγ的活性。巧的是,PPARγ就负责调节脂质吸收/代谢相关基因的表达。
这个链条比较长,简单来说,就是Snhg9增加,就会导致SIRT1活性增强,PPARγ活性降低,脂质吸收/代谢的相关基因表达都受抑制;如果Snhg9减少,则有相反的效果。
Snhg9的长相(预测图)
王宇浩等人发现,在强制表达Snhg9的小鼠中,不仅Ppaγ基因的表达减少,连参与脂肪酸吸收、运输和合成的基因表达都减少了。
与有菌小鼠相比,强制表达Snhg9的小鼠与无菌小鼠类似,肠上皮细胞中脂质含量较低,粪便中脂质含量较高。
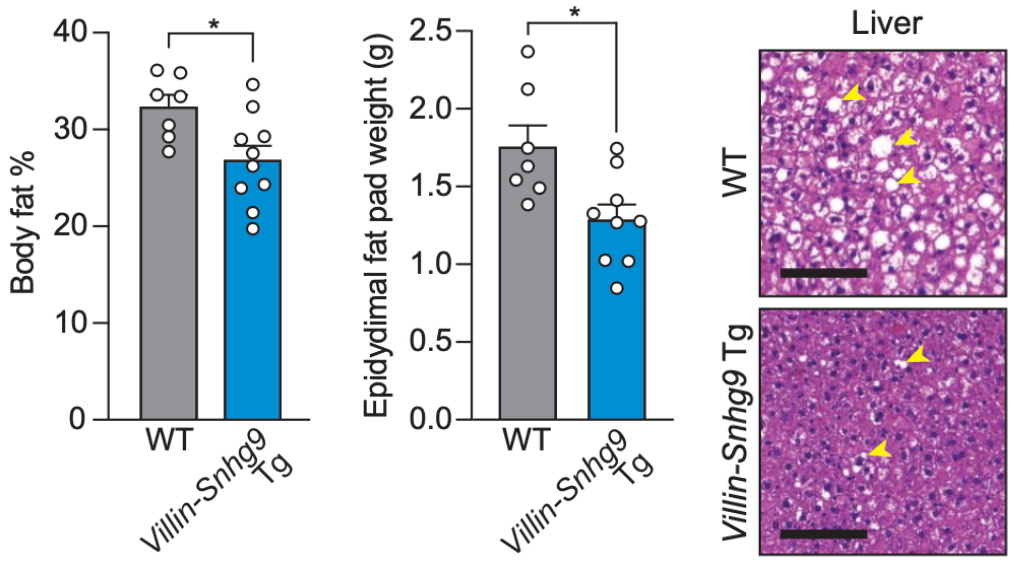
此外,在用正常饲料喂养的时候,强制表达Snhg9小鼠的体重虽然与有菌小鼠类似,但是它们的体脂百分比和附睾脂肪垫重量都较低,而且对葡萄糖的耐受性更强。
如果换成高脂饮食喂养的话,与野生有菌小鼠相比,强制表达Snhg9小鼠的体重较低,总体体脂率降低,附睾脂肪垫变小,肝脏脂肪变性程度较轻。后续的抗生素处理实验,进一步证实了肠菌通过抑制肠道Snhg9表达促进体内脂肪积累这一结论。
强制表达Snhg9的小鼠不易长肥肉
通过前面的那些实验,王宇浩等人搞清楚了在肠菌存在的条件下,宿主肠道细胞里面发生的事情。
还有一个重要问题是,肠菌的存在为啥会在肠道中引发这一连串的反应。
王宇浩等人研究发现,当细菌出现在肠道中时,细菌来源的特异性抗原会被髓样细胞上的受体识别,导致髓样细胞被激活并释放细胞因子IL-23,进一步激活3型固有淋巴样细胞(ILC3),促进IL-22的释放,直接作用于肠道上皮细胞,抑制Snhg9的表达,PPARγ活性增强,脂质吸收/代谢也增强。
简单来说,就是那些能激活髓样细胞-3型固有淋巴样细胞通路的细菌,在宿主体内调控着肠道对脂质的吸收。
机制示意图
总的来说,王宇浩和Lora Hooper团队的这个研究,发现了肠菌调节宿主脂质吸收/代谢的新机制,发现了预防和干预代谢疾病的潜在靶点。
不过,这个研究也留下了不少有意思的问题。
第一,肠菌究竟是利用哪些分子激活了髓样细胞-3型固有淋巴样细胞通路;第二,从进化的角度讲,这些细菌的存在为何会促进宿主对脂质的吸收。
来自: 奇点网
更多阅读: