不同实验室之间,生物学实验结果的可重复性广泛较差,有时即使是同一个实验室内部,实验结果也不能够得到有效的重复,这是由于一些实验变量常常会被人们忽视。例如,人类实验者的性别很少被当作一个影响实验结果的变量。但是,啮齿类动物,如小鼠,是可以区分人类性别的,男性实验者面前的小鼠常常表现得更加焦虑,而面对女性实验者的小鼠则更加放松。长期以来,实验者性别被学术界广泛忽视,不同性别如何影响小鼠实验结果目前仍然不清楚。
近日,美国马里兰大学Todd D. Gould研究团队发现,小鼠更喜欢女性人类的气味,而对男性人类的气味表现出厌恶行为,这是由于男性气味激活了小鼠大脑内嗅皮层的促肾上腺皮质释放因子(CRF)神经元,这些神经元可以投射到海马体CA1区域。并且,男性气味会通过激活小鼠内嗅皮层CRF神经元影响小鼠对于抗抑郁药物氯胺酮的行为和反应,相关研究发表于Nature Neuroscience上。

“我们在小鼠上的发现表明,激活大脑中特定的应激通路可能是改善氯胺酮治疗的一种方法。如果将氯胺酮和激活这个大脑区域结合起来,要么通过某种药物,或者是通过某种特定的压力刺激大脑中的这个过程,可能可以促进抗抑郁效果。”研究者Todd Gould表示。
研究人员首先检测了三种不同品系的小鼠对于带有男性或女性气味(擦拭肘窝、腕部和耳后)的拭子的偏好性。结果发现,无论是雄性还是雌性小鼠,都更喜欢带有女性人类气味的拭子。而在嗅觉被抑制的小鼠中,则没有观察到这一现象。并且,当让小鼠在用水浸湿的对照组拭子和擦试过男性或女性皮肤的拭子之间进行选择时,小鼠对带有男性气味的拭子表现出厌恶回避行为,而对带有女性气味的拭子表现出偏好性。
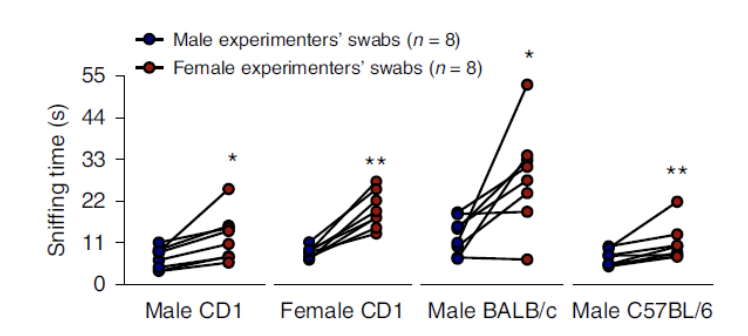
小鼠更偏好带有女性实验者气味的拭子
为了直接比较小鼠对于男性、女性和对照气味的行为差异,研究人员使用Y形迷宫进行测试,分别将不同气味的拭子放在迷宫三条通道中,检测小鼠在每一个通道中的停留时间。实验结果发现,小鼠在女性气味和对照气味通道中的停留时间没有显著性差异,而在男性气味通道中的停留时间更短。
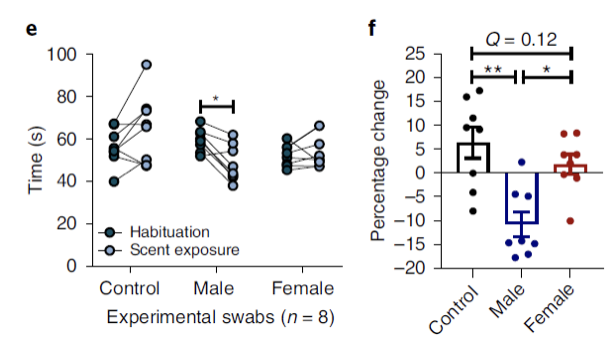
小鼠对男性实验者气味表现出厌恶回避行为
接下来,为了研究不同性别的气味是否会影响小鼠对于压力的响应,研究人员进行了各种行为学实验,检测小鼠的压力响应行为。结果发现人类实验者的气味不仅会影响小鼠的焦虑类似行为,还会影响抑郁相关行为。
那么实验者性别是否会影响药物对于小鼠实验的效果呢?为了研究这个问题,研究人员检测了实验者性别对于一种抗抑郁药物氯胺酮对小鼠的影响。由马里兰大学和耶鲁大学不同实验室的实验结果表明,由男性实验者操作的小鼠对于氯胺酮的响应发生改变,多种行为学实验证明其压力相关行为受到影响。
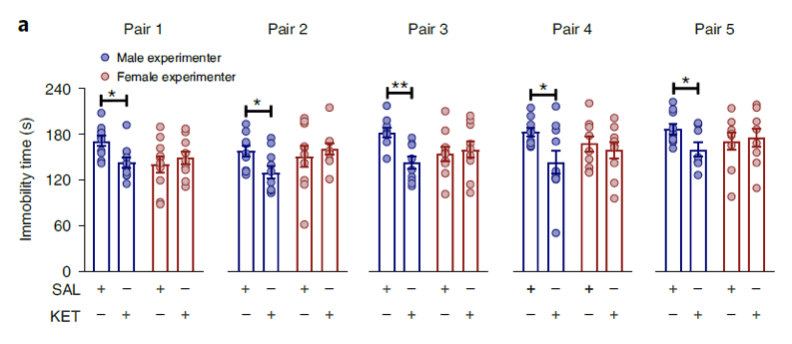
实验者性别影响氯胺酮的抗抑郁效果
由于之前有研究报道男性实验者气味会激活下丘脑–垂体–肾上腺轴,导致血浆中肾上腺皮质酮水平增加。然而,研究人员发现抑制皮质酮合成并不能改变男性实验者导致的氯胺酮相关表型。由于下丘脑–垂体–肾上腺轴的激活可以促进促肾上腺素释放因子CRF的分泌,而且皮质酮的释放受CRF的调节,研究人员猜测CRF可能介导了实验者气味影响氯胺酮抗的抑郁反应。
行为学实验结果表明,CRF确实介导了实验者性别对于氯胺酮药效的影响,而且用CRF受体拮抗剂CP-154526处理可以抑制实验者性别对于氯胺酮效果的影响。这些实验结果表明,男性气味通过CRF系统,以一种不依赖于皮质酮合成的方式,影响氯胺酮的抗抑郁效果。
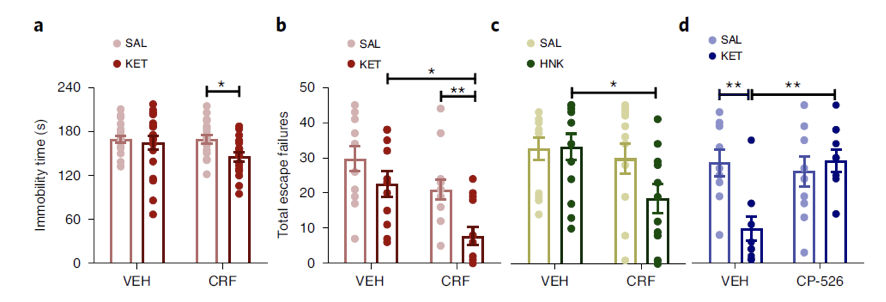
CRF介导男性气味对于氯胺酮效果的影响
已有研究报道氯胺酮代谢物羟基去甲氯胺酮HNK可以通过增加海马体突触上AMPA受体AMPAR的水平,从而加强神经活性,介导抗抑郁作用。研究人员检测发现男性实验者对小鼠进行氯胺酮给药后,海马体中AMPAR亚基GluA1表达上调。接下来研究人员记录了海马体CA1区域兴奋性突触后电位fEPSPs,发现HNK可以增强AMPAR介导的fEPSPs,并且CRF对于HNK介导的内嗅皮层EC到CA1突触的增强作用是必需的。研究人员于是猜测,从内嗅皮层EC到CA1有CRF神经元投射介导了氯胺酮的抗抑郁效果。
实验结果表明,男性气味激活了EC的CRF神经元,而且用光激活CRF EC-CA1投射可以产生与男性气味相似的厌恶反应,抑制EC-CA1投射可以逆转对于男性气味的厌恶反应。因此,CRF EC-CA1通路介导了小鼠对于人类男性气味的反应。
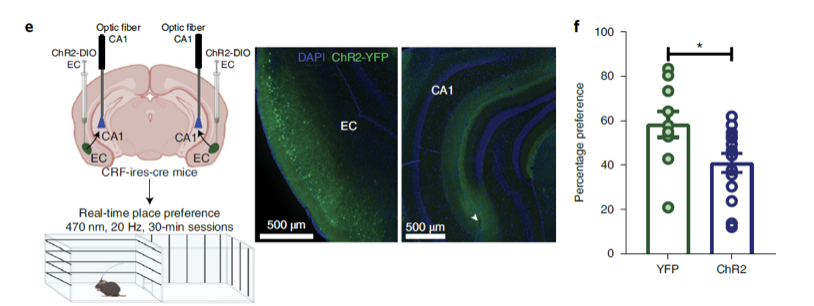
光激活CRF EC-CA1投射诱导厌恶反应
总的来说,这项研究发现了实验者性别对小鼠行为和药物反应的关系和机制,实验者性别对于实验结果的可重复性至关重要,实验者的性别不仅会影响小鼠的基本行为,还会影响小鼠对于药物处理的反应。这项研究还揭示了CRF影响氯胺酮抗抑郁效果的机制,未来通过开发将氯胺酮与CRF受体激动剂结合的临床措施可能可以更有效地干预抑郁症等疾病。
原文链接:https://doi.org/10.1038/s41593-022-01146-x
参考文献:
1. Sorge, R. E. et al. Olfactory exposure to males, including men, causes stress and related analgesia in rodents. Nat. Methods 11, 629–632 (2014).
2. Zanos, P. et al. NMDAR inhibition-independent antidepressant actions of ketamine metabolites. Nature 533, 481–486 (2016).
来自: 生物谷
更多阅读:

