阿尔茨海默病(AD)破局之艰难,不得不说一定程度上有疾病模型的问题。
AD具有多种典型的病理表现,例如神经纤维缠结、β淀粉样蛋白(Aβ)斑块、颗粒空泡变性(GVD)和神经元的丢失。但是动物模型只能够部分呈现这些特征,无法了解病理之间如何产生关联。
最主要的问题之一就是AD小鼠模型中的tau病理只能通过人工诱导,比如使用相应的tau突变或注射来自AD患者大脑的tau蛋白种子,这并不能呈现真实病理表现中Aβ诱导产生tau病理的现象,也无法回答AD中神经元如何死亡的问题。
今日,《科学》杂志发表了来自比利时科研团队的新论文,研究者们开发了一种新的AD模式小鼠,将人类神经元移植到Aβ小鼠脑内,可自发表现出tau病理等AD典型病理和神经元丢失现象。
研究者发现,其中一种长非编码RNA MEG3起了决定性作用。MEG3表达能够诱导人类神经元程序性坏死(necroptosis),且这种作用是人类特有的,小鼠神经元Meg3并不会在Aβ病理背景下改变表达。
一方面,这项研究提出了人类神经元在AD中的独特脆弱性;另一方面,也提供了针对程序性坏死途径的AD新疗法可能。

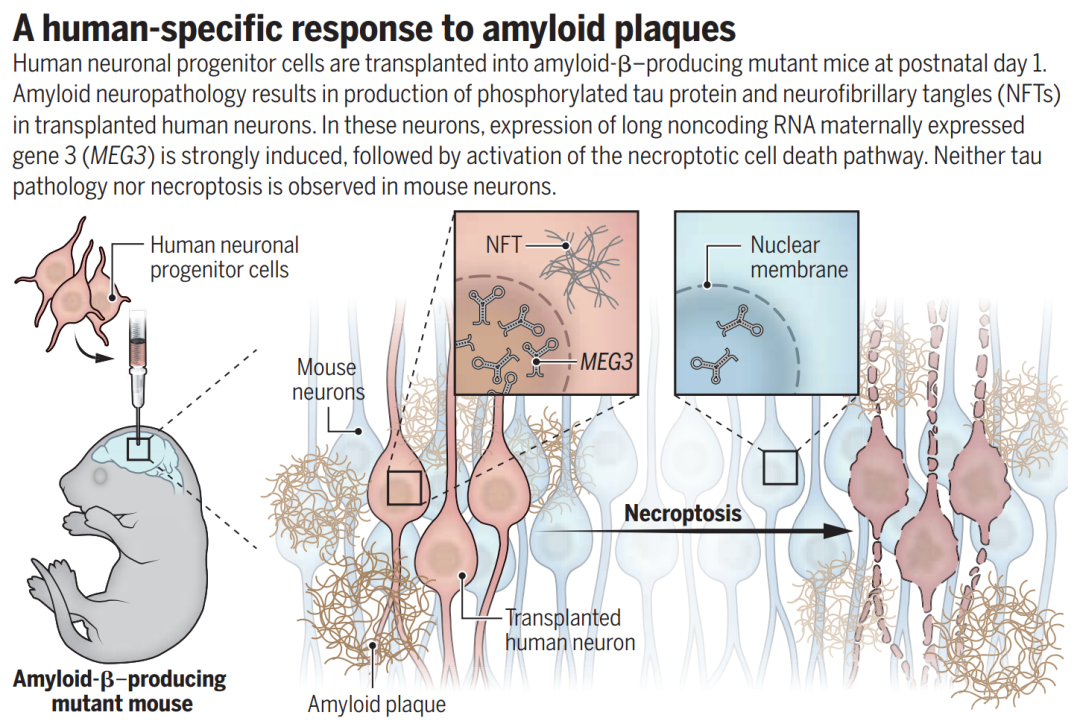
动物模型无法完全表征人类AD病理表现的问题由来已久,有两种较好的思路来解决这个问题,一是基于不同类型的人类细胞进行三维培养,一是将人类神经元异种移植到小鼠体内。
本研究就对异种移植模型进行了改良,小鼠携带免疫缺陷突变Rag-/-以接受人类干细胞来源的神经祖细胞(NPC)移植;同时,小鼠还敲入了AppNL-G-F突变,这是三种不同的可导致家族性AD的App突变。
移植两个月后,异种移植神经元已经能够表现出成熟神经元特征和皮质标记物。在移植6个月后,移植人类神经元中出现了等量的3R tau和4R tau,而宿主本身的小鼠神经元则没有tau病理。
移植18个月后,小鼠出现了完全的淀粉样斑块病理。在这个时间点,非Aβ病理对照小鼠脑内的人类神经元总体是健康的,而移植到Aβ小鼠中的人类神经元表现出了严重的小胶质细胞和星形胶质细胞增生性神经营养不良。
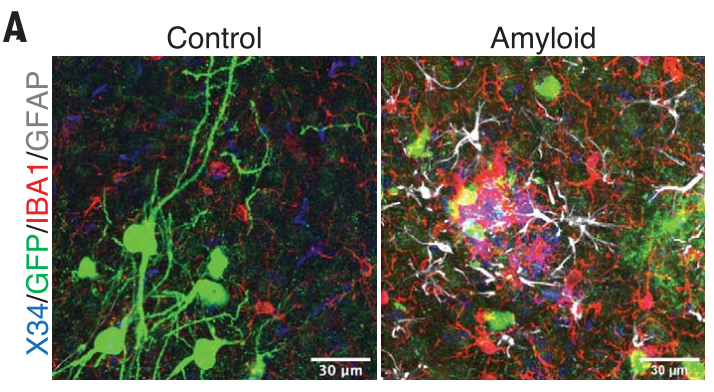
小胶质细胞(IBA1),星形胶质细胞(GFAP)
研究者使用抗磷酸化tau蛋白抗体进行了免疫组化分析,包括指向ptau Ser202和Thr205的AT8,指向ptau Ser396和Ser404的PHF1,指向病理构象tau表位的MC1。
从图中可以看出,移植人类神经元中出现了大量的神经斑tau蛋白。在Aβ斑块周围20μm范围内,2%(AT8)、5%(PHF1)、3%(MC1)被染色。这些病理在移植后6个月就出现了,说明在早期Aβ沉积就开始驱动tau磷酸化。
研究者还发现,小鼠中ptau181和ptau231的血浆水平增加,这也与人类AD患者的表现一致。
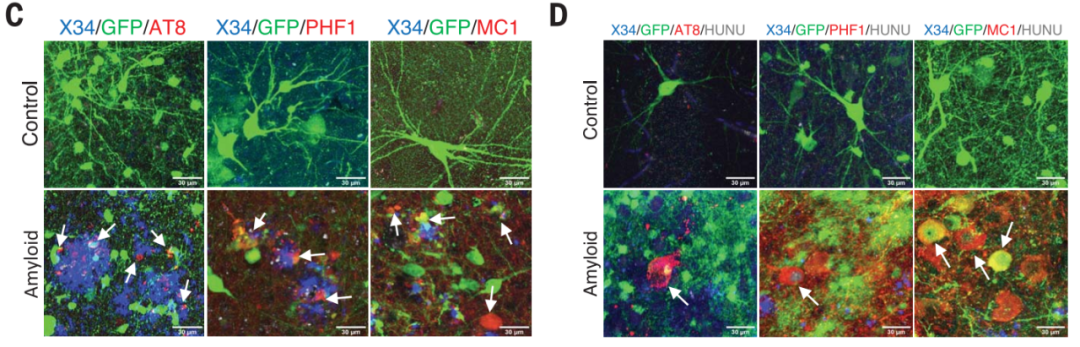
tau的免疫组化染色
通过定量PCR分析,Aβ小鼠中高达50%人类神经元死亡。
这些神经元是怎么死的?
研究者分离了小鼠2个月、6个月和18个月大时的移植神经元,提取RNA测序,人类相关平均读数约1330万。
测序结果可见移植人类神经元表现出了多种与AD真实病理对应的基因表达,此处不一一详述。关于神经元死亡的原因,研究者并未观察到与细胞凋亡或铁死亡有关的基因表达变化,但程序性坏死执行蛋白MLKL表达上调。
在AD患者的颞回中,也检测到了MLKL和另一种程序性坏死执行蛋白RIPK3表达的上调。
驱动神经元程序性坏死的到底是什么?研究者在移植人类神经元中发现了数十个表达改变的长非编码RNA,其中上调幅度最显著、超过10倍的MEG3引起了研究者的关注。
MEG3通过p53参与细胞死亡途径。虽然此前从未有研究认为MEG3参与AD,但研究者在数据库中发现,AD患者大脑也存在MEG3上调的现象。实际检测了AD患者颞回RNA,MEG3上调约2-3倍。
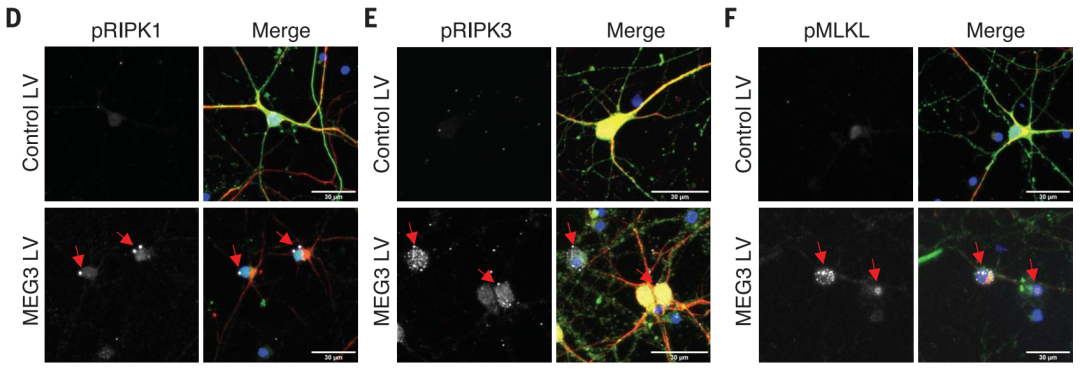
体外实验显示,MEG3过表达可以诱导神经元程序性坏死,通过CRISPR敲除程序性坏死相关RIPK1、RIPK3和MLKL,或者使用程序性坏死抑制剂ponatinib、dabrafenib、necrosulfonamide可以逆转。
过表达MEG3可检测到程序性坏死标志物
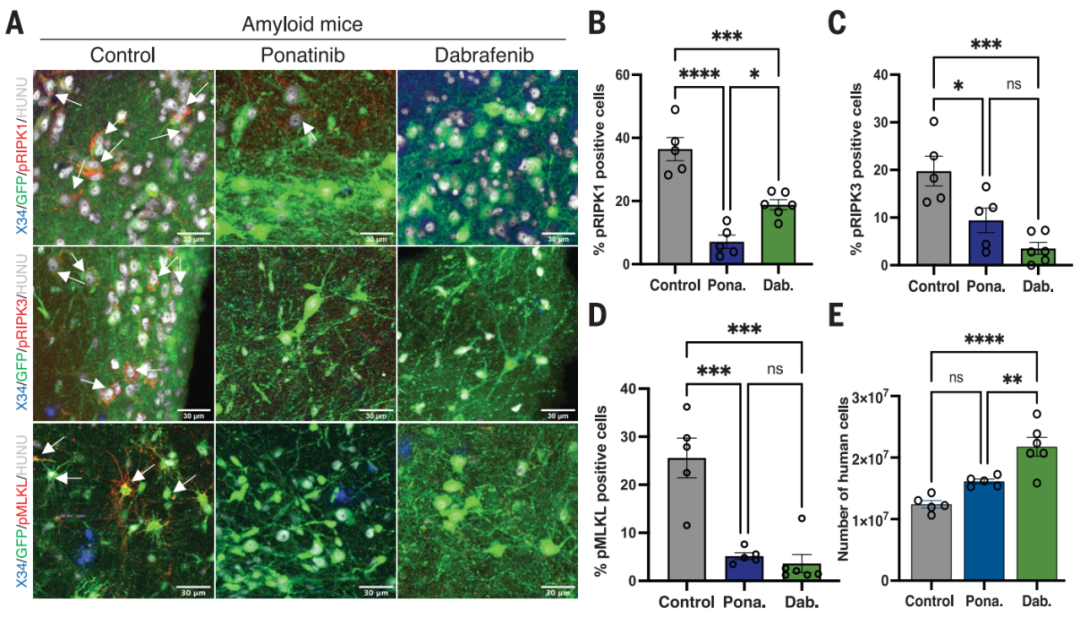
研究者也尝试给小鼠口服ponatinib(30mg/kg)或dabrafenib(50mg/kg)治疗。ponatinib是是RIPK1和RIPK3抑制剂,已被FDA批准用于治疗急性淋巴细胞白血病和慢性髓细胞白血病。dabrafenib是一种特异性更强的RIPK3抑制剂。
结果可见程序性坏死蛋白水平降低,dabrafenib组小鼠神经元死亡显著减少。
小鼠脑内程序性坏死蛋白水平和神经元数量
不过,这个小鼠模型也有很明显的缺陷,那就是免疫系统的缺席。我们知道,AD发展中,免疫的作用是不可忽视的,这使得该模型有了不可预计的偏差。
与此,《科学》同期配发的评论文章中也做出了后续改进的猜测。评论认为,这可以通过同步移植人类小胶质细胞,或者可以对小鼠的内源性神经元进行基因改造,使小鼠的Meg3也能够响应Aβ病理。
来自: 奇点神思
更多阅读: