股骨头坏死(osteonecrosis of the femoral head,ONFH)是一种致残性骨骼疾病,发病率高,治愈困难,好发于中青年,有“不死的癌症”之称。其临床主要表现为髋关节疼痛难忍、活动受限、跛行及下肢短缩等。
2015年的调查显示,我国约有812万股骨头坏死患者,其中55.75%女性患者和26.35%男性患者是由使用糖皮质激素引起1。糖皮质激素(glucocorticoid,GC)是肾上腺皮质分泌的一种激素,对机体的生长、发育、代谢和免疫等有重要作用;也是临床上广泛使用的抗炎和免疫抑制剂2。其使用不当、长期或过量使用可引起细胞凋亡、内皮细胞损伤、骨形成抑制和血管新生能力下降,是导致股骨头坏死的主要原因之一3。
然而,糖皮质激素引起股骨头坏死的机制尚未完全清楚。
越来越多研究发现肠道微生物可通过肠–骨轴影响骨骼健康4,这使得科学家从微生物角度探究骨科疾病的发病机理。
近期,《科学进展》(Science Advances)发表了中南大学湘雅医院谢辉教授团队关于糖皮质激素与肠道细菌对骨坏死的最新研究结果5。该研究通过小鼠和细胞实验,揭示动物乳杆菌(Lactobacillus animalis)分泌的胞外囊泡(EVs)可作用于股骨头,通过促成骨、促成血管和抗细胞凋亡作用,缓解糖皮质激素诱导的股骨头坏死病症。除此之外,补充动物乳杆菌也有益于巩固健康骨骼。
胞外囊泡是纳米尺度的有膜颗粒,包裹着细胞产生的生物活性分子,在原核和真核生物的细胞通讯中发挥重要作用6。该研究通过一系列实验,证实胞外囊泡会介导肠道细菌对股骨头坏死的影响。
第一步,研究者通过一个探索性实验,发现与健康小鼠共同喂养后,糖皮质激素引起的小鼠股骨头坏死症状得到缓解。小鼠被分为实验组和对照组,实验组用人工合成的糖皮质激素甲基强的松龙(methylprednisolone,MPS)处理,记为MPS组;对照组用MPS的给药载体二甲亚砜(dimethyl sulfoxide,DMSO)处理,记为Vehicle组。
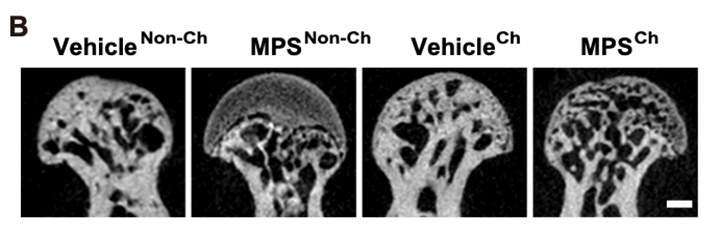
微型电脑断层扫描(uCT)观察发现,MPS组小鼠出现明显的股骨头坏死病变特征:大面积低密度区域、骨质流失、松质骨骨体积分数(小梁体积分数)下降、骨小梁厚度降低、骨小梁数目减少、骨小梁间隙增大(图1)。而Vehicle组小鼠并未出现上述病变。
图1:微型电脑断层扫描(uCT)对股骨头的扫描图。Ch: Co-housing,表示共同喂养;Non-Ch表示没有共同喂养。图中清晰显示在共同喂养后,MPSCh小鼠的股骨头病变特征得到缓解。
当把MPS组与Vehicle组小鼠共同喂养时,MPS引起的病变都有显著改善。小鼠是粪食性动物,共同喂养时会互相转移彼此的肠道微生物。因而研究者推测健康小鼠的粪便微生物可能会对骨健康有益。为验证这一猜想,研究者开展了肠道微生物干预实验。
基于健康小鼠的粪便制作提取液,通过口腔填喂方式转移到MPS组小鼠。结果显示,健康小鼠的粪便微生物能逆转MPS引起的骨小梁病变。例如,MPS组小鼠在喂食健康小鼠粪便微生物后,正常态的骨小梁面积加大,以及股骨头骨细胞空隙减小,并且股骨头处的血管明显增多(图2),缓解坏死症状。
图2:基于uCT的微血管造影术对股骨头血管的扫描图。GM: Gut Microbiota。图中清晰显示在喂食健康小鼠的肠道微生物后,MPS+GMVehicle小鼠的股骨头病变特征得到缓解。比例尺是500um。
这些实验结果表明,健康小鼠的肠道微生物能逆转糖皮质激素引起的股骨头坏死病变。
顺藤摸瓜,研究者通过分子生物学技术,精准锁定能对股骨头起保护作用的细菌。
他们使用16S rRNA靶向基因测序,检测实验前后小鼠肠道微生物的组成。令人振奋的是,研究者锁定乳酸杆菌属(特别是动物乳酸杆菌和肠乳酸杆菌[Lactobacillus intestinalis])的丰度在MPS处理后的小鼠中下降,在与健康组小鼠共同喂养后上升(P<0.01,图3)。
图3:基于16S rRNA基因测序分析得到的小鼠肠道微生物组成。B图表示整个微生物菌群的组成,左边是相对丰度,右边是绝对丰度。C图表示动物乳酸杆菌在不同实验组的差异。
为提升研究的可靠性,研究者用荧光定量PCR(qRT-PCR)测量不同时间点小鼠的动物乳酸杆菌的丰度。结果显示,动物乳酸杆菌的丰度在MPS干预1星期后出现下降(P<0.05),并且在第2和第3个星期都保持一个较低的水平。这些证据表明,糖皮质激素抑制动物乳酸杆菌的生长,暗示着该细菌有潜在的骨保护作用。
找到了标志菌,接下来就是验证这个细菌是否有骨保护作用。给MPS处理的小鼠喂食动物乳酸杆菌后,uCT扫描发现MPS引起的骨小梁损伤、小梁体积分数下降、骨小梁数目减少、骨小梁间隙增大均得到明显改善。在健康小鼠中,喂食动物乳酸杆菌后,骨小梁厚度和数目增加,骨小梁间隙减小。这说明,动物乳酸杆菌不仅能逆转糖皮质激素引起的骨损伤,也有益于健康小鼠的骨健康。
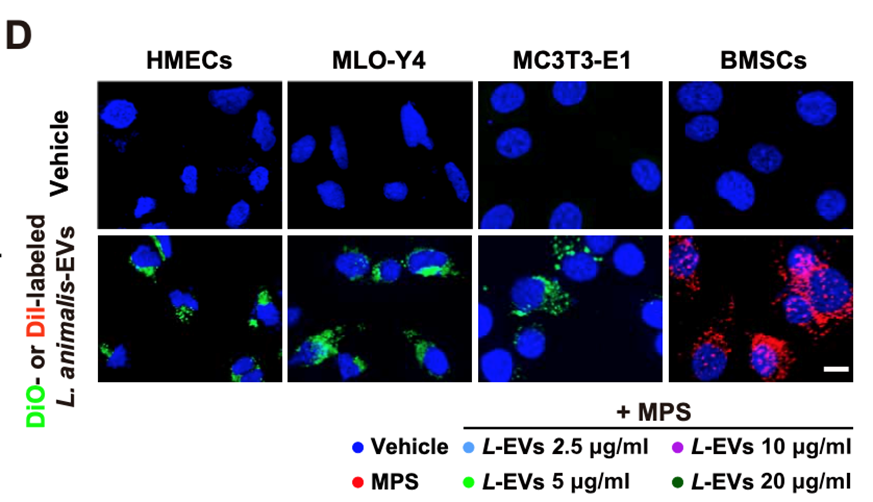
动物乳酸杆菌通过何种方式起到骨保护作用?研究者聚焦到动物乳酸杆菌的胞外囊泡。在与人微血管内皮细胞(HMECs)、小鼠长骨骨细胞(MLO-Y4)、小鼠前成骨细胞细胞(MC3T3-E1)和小鼠骨髓间充质干细胞(BMSCs)共同培养时,动物乳酸杆菌的胞外囊泡可进到这些细胞内部的细胞核区域(图4),暗示着其可以直接影响动物细胞。另外,研究者还发现乳酸杆菌的胞外囊泡能促进血管生成。
图4:染色标记发现动物乳酸杆菌胞外囊泡能进入动物细胞内部。
在小鼠体内,乳酸杆菌胞外囊泡是否能冲破重重障碍,到达股骨头细胞?体外染色实验表明,喂食乳酸杆菌胞外囊泡后,小鼠的多种组织细胞中都能观测到乳酸杆菌胞外囊泡。这些组织包括肝脏、脾脏、肺部、胃部、肾脏和骨骼。并且,在股骨头细胞中,乳酸杆菌胞外囊泡随时间而减少,很可能是被宿主细胞给代谢和利用。
与口服动物乳酸杆菌效果类似,喂食胞外囊泡能增加MPS组小鼠的股骨头血管生成(P<0.001),增加内皮细胞数量(P<0.001),从而缓解股骨头坏死症状。
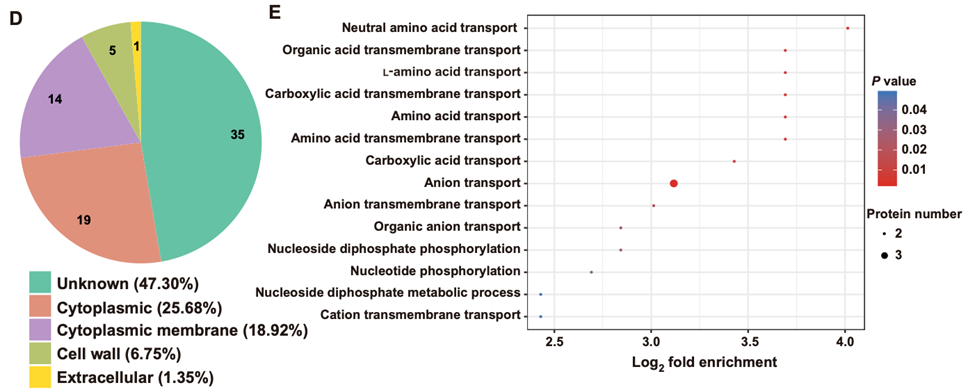
最后,研究者通过质谱分析乳酸杆菌及其胞外囊泡的蛋白组成。在1000多种蛋白中, 74种蛋白在胞外囊泡的水平显著高于胞内水平。功能分析揭示,胞外囊泡富集蛋白主要是具有转运功能的蛋白(图5),支持了胞外囊泡作为细胞间通讯的纽带这一角色。
图5:在动物乳酸杆菌胞外囊泡富集蛋白的功能注释。D图表示Gene ontology(GO)注释结果。E图表示代谢通路富集分析结果。
综上,谢辉团队通过一系列的小鼠、细胞和分子实验,揭示了动物乳酸杆菌通过胞外细胞囊泡抑制糖皮质激素引起股骨头坏死的机制。
遗憾的一点,该研究是基于小鼠模型,动物乳酸杆菌对人体是否有骨保护作用还未知。希望这一研究突破能推动乳酸杆菌对人体骨保护作用的研究。
来自: 奇点网
更多阅读: