睡眠,尤其是深度睡眠,对人体的健康非常重要。
有很多研究发现了睡眠不足与痴呆风险增加有关。然而,随着年龄的增加,人类的睡眠时长和结构会发生变化。这些变化如何影响痴呆症的风险,目前仍需要探索。
近日,由澳大利亚莫纳什大学Matthew P. Pase领衔的研究团队,在著名期刊JAMA Neurology上发表了一项重要研究成果[1]。
他们分析弗莱明翰心脏研究队列的数据发现,随着年龄增长,参与者睡眠中最深的慢波睡眠(SWS,或非快速眼动睡眠)占比会下降,如果参与者携带阿尔茨海默病遗传风险基因APOE4,慢波睡眠会随着年龄的增长而加速下降。
在量化相关数据之后,他们发现,慢波睡眠占比每年每减少1%,患痴呆症的风险会增加28%,患阿尔茨海默病相关痴呆的风险会增加32%。
论文首页截图
Pase这个研究从弗莱明翰心脏研究队列筛选了346名参与者,他们的平均年龄为69岁,其中女性179名(52%),黑人27名(8%),西班牙裔18名(5%),太平洋岛民10名(3%),剩余291名(84%)为白人。
所有参与者都做了两次夜间多导睡眠图(PSG)监测,且在第二次监测时没有被确诊为痴呆症。研究的主要终点是,第2次PSG后17年的全因痴呆发生风险。
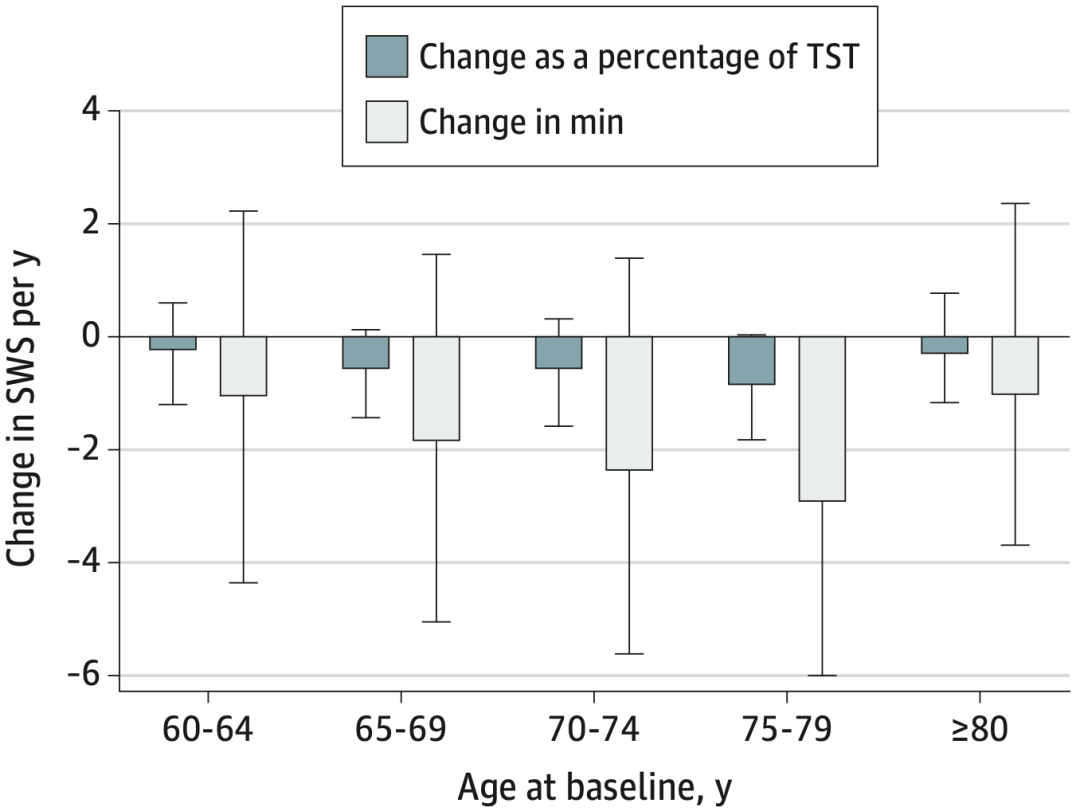
从数据来看,在基线时,慢波睡眠的平均占比为18.1%。在研究的随访时间内,慢波睡眠的占比每年减少0.57个单位。而且慢波睡眠的减少速度从60岁开始显著加快,在75至80岁减少速度达到峰值,随后放缓。
慢波睡眠随年龄的变化趋势
在最长达17年的随访时间里,有52名参与者确诊为痴呆症,其中44例是阿尔茨海默病相关痴呆症。
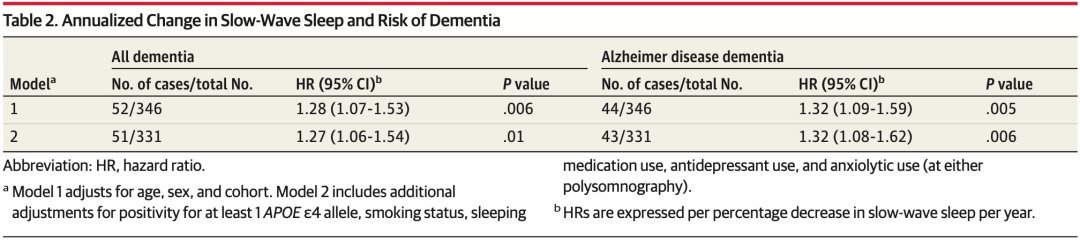
在对年龄、性别和队列进行调整后,慢波睡眠每年每下降一个百分点,全因痴呆的风险就会增加28%,而阿尔茨海默病相关痴呆的风险则会增加32%(模型1)。
在对至少1个APOE4等位基因阳性、吸烟状况、安眠药使用、抗抑郁药使用和抗焦虑药使用进行进一步调整后,慢波睡眠每年每减少一个百分点,全因痴呆风险就会增加27%,而阿尔茨海默病相关痴呆风险则会增加32%(模型2)。
风险数据
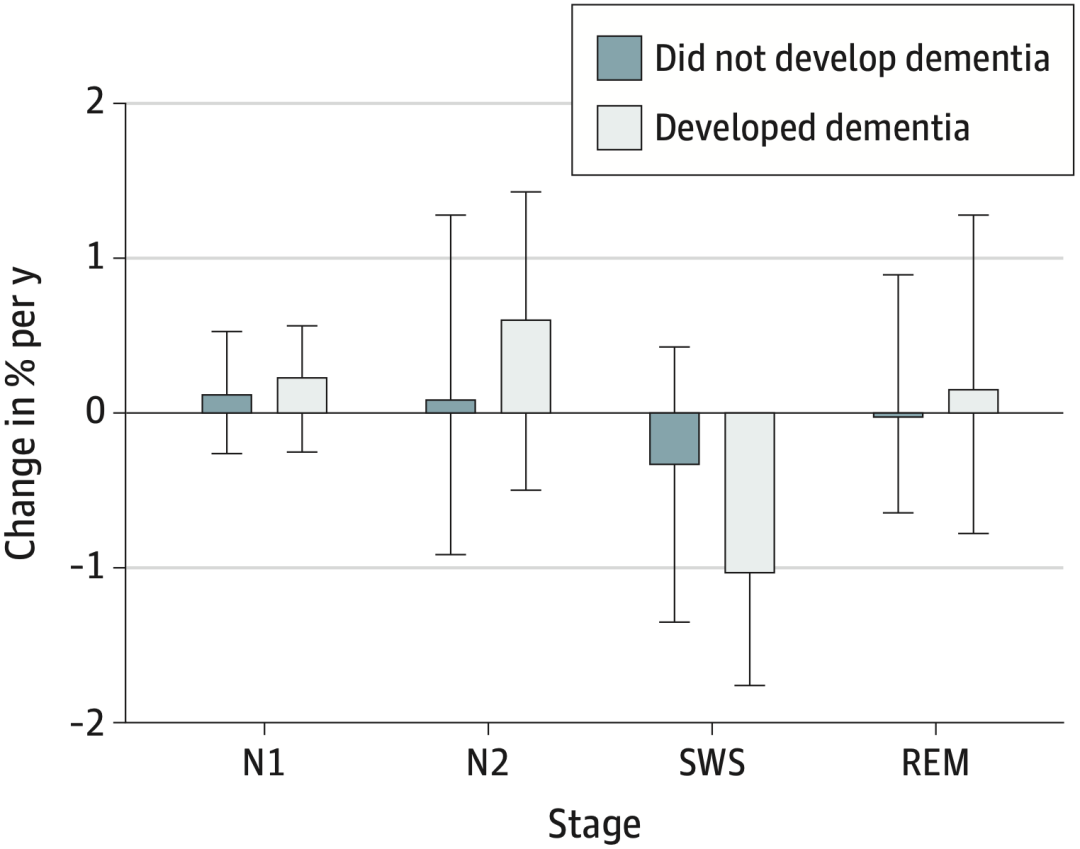
值得注意的是,Pase团队还比较了最终患痴呆症和未患痴呆症参与者的慢波睡眠百分比变化。
他们发现,痴呆症患者的慢波睡眠占比平均下降率(每年-1.03)是未发病者(每年-0.48)的两倍以上。
确诊者的慢波睡眠(SWS)占比降幅惊人
在研究的最后,Pase团队探索了APOE基因型与慢波睡眠和痴呆之间的相互关系。
从参与者的基因型数据来看,232名参与者(67%)为APOE3/3,76名参与者(22%)至少有一个APOE4等位基因,37名参与者(11%)为APOE3/2或APOE2/2。
在根据年龄、性别和队列调整后的线性回归中,APOE4携带者的慢波睡眠下降幅度大于APOE3/3(P=0.04),而APOE3/2或2/2与APOE3/3相比,慢波睡眠下降的差异不显著。
APOE与慢波睡眠(SWS)之间的关系
虽然,在一项因果中介分析中发现APOE4对痴呆症发病风险影响,有17%是通过慢波睡眠百分比的变化介导的,但是在统计学上并不显著(P=0.11)。因此,Pase团队认为,至少在这个队列中,慢波睡眠占比的变化不是APOE4驱动痴呆症的中介因素。
总的来说,Pase团队的这个研究表明,在60岁及以上的成年人中,慢波睡眠占比会随着时间的推移而下降,而且下降幅度越大,未来患痴呆症的风险就越大。
实际上,Pase团队的这一发现并不让人意外。因为已经有不少基础研究发现,慢波睡眠对大脑清除代谢废物至关重要[2-4]。此外,还有研究发现,慢波睡眠的慢波活动是一种认知储备因子,可提供对高阿尔茨海默病病理负担引起认知障碍的抗性[5]。
无论如何,希望大家都有好睡眠。
参考文献:
[1].Himali JJ, Baril AA, Cavuoto MG, et al. Association Between Slow-Wave Sleep Loss and Incident Dementia. JAMA Neurol. 2023;e233889. doi:10.1001/jamaneurol.2023.3889
[2].Xie L, Kang H, Xu Q, et al. Sleep drives metabolite clearance from the adult brain. Science. 2013;342(6156):373-377. doi:10.1126/science.1241224
[3].Fultz NE, Bonmassar G, Setsompop K, et al. Coupled electrophysiological, hemodynamic, and cerebrospinal fluid oscillations in human sleep. Science. 2019;366(6465):628-631. doi:10.1126/science.aax5440
[4].Bojarskaite L, Vallet A, Bjørnstad DM, et al. Sleep cycle-dependent vascular dynamics in male mice and the predicted effects on perivascular cerebrospinal fluid flow and solute transport. Nat Commun. 2023;14(1):953. doi:10.1038/s41467-023-36643-5
[5].Zavecz Z, Shah VD, Murillo OG, et al. NREM sleep as a novel protective cognitive reserve factor in the face of Alzheimer’s disease pathology. BMC Med. 2023;21(1):156. doi:10.1186/s12916-023-02811-z
来自: 奇点神思
更多阅读: