说起过敏性休克,大家应该都不陌生。
在日常生活中,一些人在接触到特定过敏原(如花生或海鲜)后,会出现舌头/喉头水肿、呼吸急促,甚至晕倒的症状,这就是过敏反应引起的休克。过敏性休克通常在暴露于过敏原后几分钟到半小时内发生,且症状急速进展,严重时可危及生命。
过敏性休克并不罕见。据统计,1.6%-5.1%的美国人曾经历过敏性休克,而且每3分钟就有一人因食物型过敏性休克送进急诊室。
目前针对过敏性休克的唯一急救方法是注射肾上腺素。不过肾上腺素只是缓解症状,而非针对过敏反应本身。此外,紧急使用肾上腺素可能出现因药物过量引起患者心跳过速等问题。
不难看出,过敏性休克亟需新的治疗方案。遗憾的是,科学家对过敏性休克的发生机制还缺乏深入的了解,这也限制了相关药物的研发。
好消息是,杜克大学Soman Abraham研究组,近日在著名期刊《科学·免疫学》上发表的一项研究成果[1],首次证实神经系统也在过敏性休克中扮演了重要的角色,为过敏性休克的预防和治疗提供了新思路。杜克大学包纯净博士是论文的第一作者。
论文标题
从教科书上我们知道,过敏反应的发生很大程度上与致敏的肥大细胞的激活有关。
肥大细胞位于各种外周器官和组织的血管旁,当进入机体循环的过敏原与致敏的肥大细胞接触的时候,肥大细胞会迅速脱颗粒化,以释放细胞内储存的颗粒。这些颗粒里包含大量不同的炎症介质,包括组胺、蛋白酶和肝素等,可以促进血管扩张和血管渗透性增加[2]。
长久以来,学界都认为肥大细胞释放的炎症介质引起的血管性变化,是导致过敏性休克的主要原因[3]。但是,Abraham带领的团队认为,这个机制无法解释为何位于外周组织的肥大细胞可以如此迅速地促进过敏性休克的发生,因为有的过敏性休克的发生快至几分钟(如青霉素过敏)。
实际上,在众多外周组织中,肥大细胞和神经纤维也是在咫尺之间,而且神经系统可以迅速调节血压和体温等生理反应。基于此,Abraham团队想知道神经系统是否参与了过敏性休克的发生。
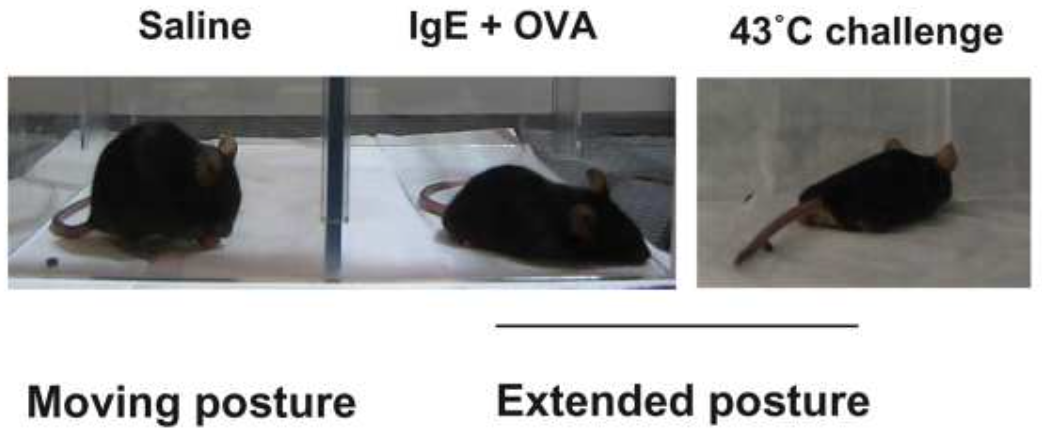
带着这个问题,他们回顾了小鼠的过敏性休克反应,除了标志性的温度骤降,他们还发现了一个很有意思的现象——这些小鼠均呈现出一种很不常见的姿势——趴着的姿势(extended posture)。巧的是,之前有研究报道这种行为也见于下丘脑温觉中枢被激活之时[4]。
过敏性休克和热挑战中的小鼠趴下了
鉴于此,他们做出了一个大胆的猜想:神经系统在过敏性休克中确实具有重要作用。他们计划用小鼠模型进行探究,由于温度骤降是小鼠过敏性休克最显著的现象,他们主要围绕温度调节展开了研究。
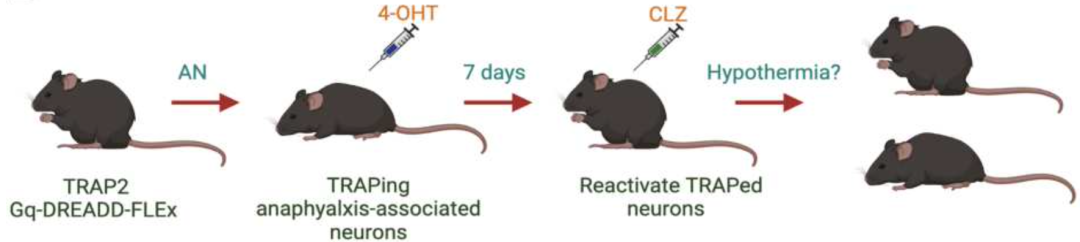
Abraham团队首先基于过敏性休克模型和TRAP2-GqDREADD化学基因操控相结合的方法,证实了在过敏性休克中中枢神经系统的某些神经元会被激活。通过标记这些神经元,他们发现重新激活这些神经元可以导致类似于过敏性休克的低温反应。
化学基因操控方法
由于检测到的是低温反应,他们接下来特别地关注了温觉调节神经轴在此过程中是否被激活。通过神经元染色,他们证实温觉调节神经轴确实是被激活了,包括感觉神经元,位于脑干的LPBd和下丘脑视前核的MnPO的神经元。
他们还发现,当过敏性休克导致温度调节神经轴被激活时,小鼠产生的产热(即棕色脂肪组织产生的热能)明显受到了抑制,这也就解释了为什么小鼠体温会出现急剧下降。
接着他们探究了是哪一种感觉神经元在过敏性休克中被激活,并将信号传入中枢神经系统的温觉调节神经轴,引起低温反应。他们利用转基因小鼠敲除模型和AAV基因挽救策略,发现TRPV1+感觉神经元是过敏性反应中激活温觉调节神经轴的主要感觉神经元。
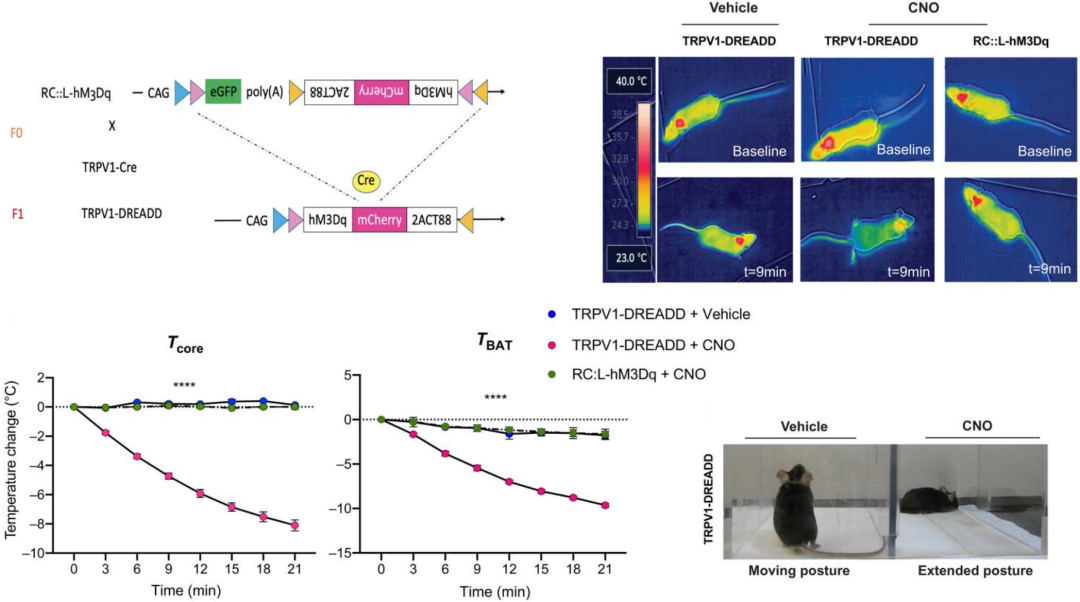
随后,他们使用化学基因操控方法证实,单单激活全身的TRPV1+感觉神经元,就可以导致小鼠呈现类似过敏性休克的反应,不仅限于低温反应,还包括温觉调节神经轴的激活,棕色脂肪组织产热下降,以及趴着不想动。
TRPV1+感觉神经元全身性激活导致的反应
更有意思的是,他们还发现全身性激活TRPV1+感觉神经元还会引起显著的血压下降,而我们知道血压骤降是过敏性休克的另一主要症状。
接下来的问题是,肥大细胞位于TRPV1+感觉神经元的上游还是下游呢?二者之间又是如何互动的呢?
借助于肥大细胞敲除的小鼠模型,他们证实肥大细胞的激活位于TRPV1+感觉神经元以及温觉调节神经轴的上游。也就是说,是激活的肥大细胞把信号传递给了TRPV1+感觉神经元。
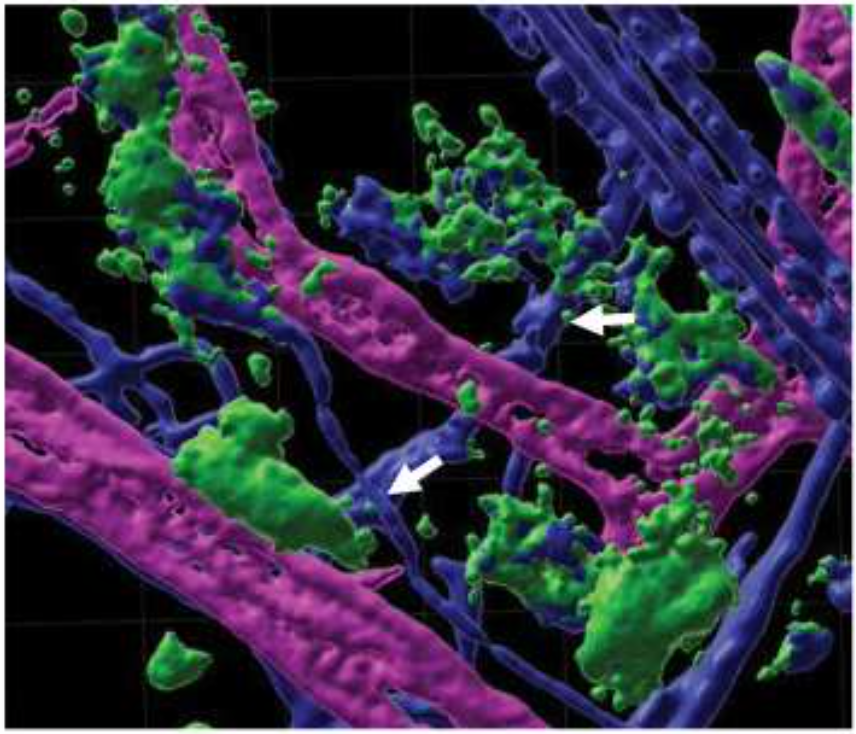
通过组织免疫荧光染色、共聚焦拍照和3D模拟,他们发现在外周多种组织中都可以看到一个很奇特的现象——肥大细胞脱颗粒化后释放的颗粒附着于临近的神经纤维之上。这种密切的接触,可能导致肥大细胞的介质以最高浓度到达神经纤维,从而最大限度地激活神经。
肥大细胞的颗粒(绿,小点)附着于临近的神经纤维(蓝)上,如箭头所示
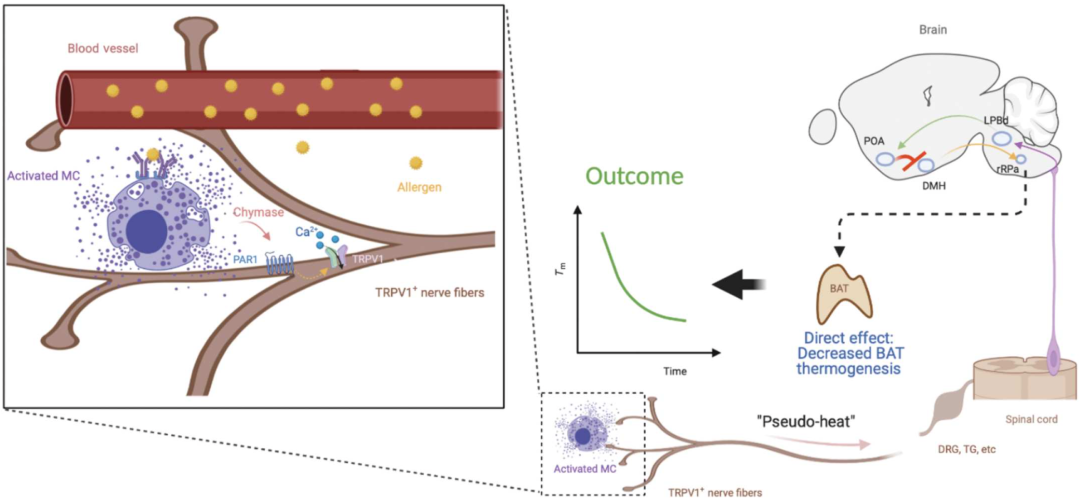
从机制上讲,他们发现肥大细胞颗粒中含量最高的chymase蛋白酶,会通过TRPV1+感觉神经元上表达的受体PAR1来激活TRPV1+感觉神经元。
总的来说,这项研究首次发现神经系统也是过敏原引起的过敏性休克反应的关键因素,并揭示了背后的分子机制。
具体来说,致敏的肥大细胞被过敏原激活后,不仅释放颗粒导致血管性变化,而且还通过颗粒和释放的chymase激活TRPV1+感觉神经元,而这些感觉神经元则进一步激活下游神经通路,导致温度和血压骤降。
总结模型
值得一提的是,这一机制的发现,为预防甚至治疗过敏性休克提供了新的方向。例如,针对肥大细胞→TRPV1+感觉神经元→温觉调节神经轴,或能开发出新型预防过敏性休克的方法,进而改善众多过敏患者的生活质量。
参考文献:
[1]. Bao C, Chen O, Sheng H, et al. A mast cell-thermoregulatory neuron circuit axis regulates hypothermia in anaphylaxis. Sci Immunol. 2023;8(81):eadc9417. doi:10.1126/sciimmunol.adc9417
[2]. Lieberman P, Garvey LH. Mast Cells and Anaphylaxis. Curr Allergy Asthma Rep. 2016;16(3):20. doi:10.1007/s11882-016-0598-5
[3]. Kemp SF, Lockey RF. Anaphylaxis: a review of causes and mechanisms. J Allergy Clin Immunol. 2002;110(3):341-348. doi:10.1067/mai.2002.126811
[4]. Takahashi TM, Sunagawa GA, Soya S, et al. A discrete neuronal circuit induces a hibernation-like state in rodents. Nature. 2020;583(7814):109-114. doi:10.1038/s41586-020-2163-6
来自: 奇点神思
更多阅读: